在500 mL 0.1 mol?L-1的FeCl2溶液中 通入一定量Cl2 待反应结束后 将溶液稀释
| 在500 mL 0.1 mol?L-1的FeCl2溶液中,通入一定量Cl2,待反应结束后,将溶液稀释到1 L,再取出1/10稀溶液,加入足量的AgNO3溶液,共得到2.009 g沉淀。问:原溶液中的Fe2+是否完全被氧化?若未完全氧化,试求Fe2+被氧化的质量分数(不考虑Cl2与H2O的反应)。 |
参考解答
| 否 80% |
| 设被氧化的Fe2+的物质的量为x。 2Fe2++Cl2══2Fe3++2Cl- 2 mol 2 mol x ( 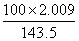 mol-0.1×0.5×2 mol) mol-0.1×0.5×2 mol)x='0.04' mol 被氧化的Fe2+∶ 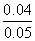 ×100%=80% ×100%=80%剩余的Fe2+∶ 0.1 mol·L-1×0.5 L-0.04 mol=0.01 mol |
相似问题
钾是活泼的碱金属 钾和氧有氧化钾(K2O) 过氧化钾(K2O2)和超氧化钾(KO2)等多种化合物.(
钾是活泼的碱金属,钾和氧有氧化钾(K2O)、过氧化钾(K2O2)和超氧化钾(KO2)等多种化合物.(1)钾和硝酸钾反应可制得氧化钾:K+KNO3→K2O+N2(未配平
向盛有KI溶液的试管中加入少许CCl4后滴加新制的氯水 CCl4层变成紫色。如果继续向试管中滴加氯水
向盛有KI溶液的试管中加入少许CCl4后滴加新制的氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。完成下列填空
用水热法制备Fe3O4纳米颗粒的总反应如下:3Fe2++ 2S2O32-+O2+4OH-= Fe3O
用水热法制备Fe3O4纳米颗粒的总反应如下:3Fe2++ 2S2O32-+O2+4OH-= Fe3O4 + S4O62-+2H2O。下列说法正确的是()A.在反应中1molO2氧化了3mol Fe
古老但仍然是最有用的制备联氨溶液的方法如下:NaClO+2NH3·H2O = N2H4 +NaCl+
古老但仍然是最有用的制备联氨溶液的方法如下:NaClO+2NH3·H2O = N2H4 +NaCl+3H2O(1)请在上述化学方程式中用单线桥法标出电子转移的方向和数目。__
二氧化氮(NO2)是重要的空气污染物 科学家正寻求合适的 化合物G与适当的条件以进行如下反应 从而将
二氧化氮(NO2)是重要的空气污染物,科学家正寻求合适的 化合物G与适当的条件以进行如下反应,从而将二氧化氮转化为无毒的N2:NO2 + G→N2 +H2O +nY












