氧化还原滴定与酸碱中和滴定一样是化学实验室常用的定量测定方法。某氧化还 原滴定的反应体系中有反应物和
氧化还原滴定与酸碱中和滴定一样是化学实验室常用的定量测定方法。某氧化还 原滴定的反应体系中有反应物和生成物共六种,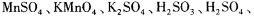  ,其中H2SO3的还原性最强,KMnO4的氧化性最强。对此反应体系: ,其中H2SO3的还原性最强,KMnO4的氧化性最强。对此反应体系:(1) 被氧化的元素是_______;发生还原反应的过程是________→______。 (2) 请用这六种物质组织一个合理的化学反应,写出它的离子方程式:_______ (3) 反应中H2SO4是_______ (填编号) A,氧化剂 B.氧化产物 C.生成物 D.反应物 (4) 当有20mL 0.1mol/L的氧化剂参加反应时,电子转移数目是_______ 。 (5) 用标准KMnO4溶液滴定H2SO3时,滴定终点时颜色变化是_______。 (6) 滴定过程中.下列图像所表示的关系正确的是_______(填编号)。 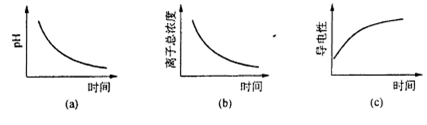 |
参考解答
| (11分) (1) +4价的 S(1分); KMnO4 → MnSO4(2分); (2) 2MnO4- +5H2SO3 =2Mn2+ +5SO42- +4H++3H2O(1分); (3) B、C (2分); (4) 0.01NA(或6.02×1021)(2分); (5)溶液由无色变为紫红色,且半分钟内不变色 (1分);(6) (a)(c) (2分) |
试题分析:(1) H2SO3的还原性最强,说明其中的+4价的S元素易被氧化,KMnO4的氧化性最强,说明发生还原反应,故被氧化的元素是+4价的S,发生还原反应的过程是KMnO4 → MnSO4。 (2) H2SO3的还原性最强,反应中做为还原剂,KMnO4的氧化性最强,反应中做为氧化剂,离子方程式为2MnO4- +5H2SO3 =2Mn2+ +5SO42- +4H++3H2O。 (3) H2SO4是H2SO3被氧化后生成的产物,故反应中H2SO4是氧化产物,故错BC。 (4)根据离子方程式分析,2molMnO4-转移电子数为10 NA电子,故20mL 0.1mol/L,即0.002mol的氧化剂参加反应时,电子转移数目是0.01NA(或6.02×1021)。 (5)反应过程中,紫红色的KMnO4生成为无色的MnSO4,故用标准KMnO4溶液滴定H2SO3时,滴定终点时颜色变化是溶液由无色变为紫红色,且半分钟内不变色。 (6) 滴定过程中,有酸生成,故pH减小,故(a)正确;反应物H2SO3是弱电解质,部分电离,生成的H2SO4是强电解质,全部电离,离子难度增大,导电性增强,故(b)错误,(c)正确。故选(a)(c)。 点评:本题考查氧化反应的应用和酸碱中和滴定,题目难度中等,注意把握滴定原理以及实验的误差分析,为该题的易错点。 |
相似问题
根据下列反应判断有关物质还原性由强到弱的顺序是 H2SO3 + I2 + H2O ='==' 2HI
根据下列反应判断有关物质还原性由强到弱的顺序是H2SO3 + I2 + H2O ="==" 2HI + H2SO4 2FeCl3 + 2HI ="==" 2FeCl2 + 2HCl + I23FeCl2
宋代著名法医学家宋慈的《洗冤集录》中有银针验毒的记载 “银针验毒”涉及的化学反应是 4Ag+2H2S
宋代著名法医学家宋慈的《洗冤集录》中有银针验毒的记载,“银针验毒”涉及的化学反应是 4Ag+2H2S+O2→2X+2H2O,下列说法正确的是A.X的化学式为AgS B
据悉 2010年田径世锦赛上使用的发令枪所用的“火药”成分是氯酸钾和红磷 经撞击发出响声 同时产生白
据悉,2010年田径世锦赛上使用的发令枪所用的“火药”成分是氯酸钾和红磷,经撞击发出响声,同时产生白色烟雾。撞击时发生的化学方程式为: 5KClO3+6P=3
复印机工作时产生臭氧 臭氧的浓度过高时对人体有害。臭氧可使湿润的淀粉碘化钾试纸变蓝 反应为:2KI+
复印机工作时产生臭氧,臭氧的浓度过高时对人体有害。臭氧可使湿润的淀粉碘化钾试纸变蓝,反应为:2KI+O3+H2O=2KOH+I2+O2,下列结论正确的是()A.O3在
写出下列反应的化学方程式。若是氧化还原反应 请用“双线桥”分析(指出氧化剂 还原剂)。(1)电解食盐
写出下列反应的化学方程式。若是氧化还原反应,请用“双线桥”分析(指出氧化剂、还原剂)。(1)电解食盐水制取氯气(2)氯气通入溴化钾溶液中(3)漂白












