钒具有众多优异的性能 用途十分广泛 有金属“维生素”之称。完成下列填空:(1)将废钒催化剂(主要成分
| 钒具有众多优异的性能,用途十分广泛,有金属“维生素”之称。完成下列填空: (1)将废钒催化剂(主要成分V2O5)与稀硫酸、亚硫酸钾溶液混合,充分反应,所得溶液显酸性、含VO2+、K+、SO42–等。写出该反应的化学方程式 。 (2)向上述所得溶液中加入KClO3溶液,充分反应后,溶液中新增加了VO2+、Cl–。写出并配平该反应的离子方程式,并标出电子转移的数目和方向 。 (3)在20.00mL的0.1mol/LVO2+溶液中,加入0.195g锌粉,恰好完成反应,则还原产物可能是 。 a.V b.V2+ c.VO2+ d.VO2+ (4)已知V2O5能和盐酸反应生成氯气和VO2+。请再写一个离子反应方程式,说明还原性:SO32–>Cl–>VO2+ 。 |
参考解答
| (1)V2O5 +K2SO3+2H2SO4→2VOSO4+K2SO4+2H2O (2分) (写成离子方程式也给分 V2O5 + SO32–+4H+→2VO2++ SO42–+2H2O ) (2) 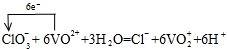 (配平1分,电子转移的数目及方向1分) (配平1分,电子转移的数目及方向1分)(3)b(2分) (4)Cl2+ SO32–+ H2O→2Cl–+ 2H++ SO42–(2分) |
试题分析:(1)由题意可知,V2O5与稀硫酸、亚硫酸钾反应生成VOSO4、K2SO4,根据原子守恒可知还生成H2O。其中V的化合价从+5价降低到+4价,得到1个电子。亚硫酸钾中S元素的化合价从+4价升高到+6价,失去2个电子,因此根据电子得失守恒可知,氧化剂与还原剂的物质的量之比是1:1,所以配平后方程式为V2O5+K2SO3+2H2SO4=2VOSO4+K2SO4+2H2O。 (2)ClO3-与VO2+反应生成VO2+、Cl-,氯元素化合价由+5价降低为-1价,共降低6价。V元素化合价由+4升高为+5价,共升高1价,化合价升降最小公倍数为6,故ClO3-的系数为1、VO2+系数为6,由原子守恒可知成VO2+的系数为6,Cl-的系数为1,由电荷守恒可知还生成H+,系数为6,故有水参加反应,系数为3,因此配平该反应的离子方程式,并标出电子转移的数目和方向为 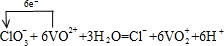 。 。(3)0.195g锌粉的物质的量=0.195g÷65g/mol=0.003mol,设V元素在还原产物中的化合价为a,则根据电子得失守恒可知0.003×2=0.02L×0.1mol/L×(5-a),解得a=2,答案选b。 (4)在氧化还原反应中还原剂的还原性强于还原产物的,V2O5能和盐酸反应生成氯气和VO2+,故还原性Cl->VO2+,氯气可以将亚硫酸根氧化生成硫酸根、自身被还原为Cl-,可以说明还原性SO32->Cl-,反应离子方程式为Cl2+SO32-+H2O=2Cl-+2H++SO42-。 |
相似问题
某校化学实验兴趣小组在“探究溴水与氯化亚铁溶液反应”的实验中发现:在足量的稀氯化亚铁溶液中 加入1—
某校化学实验兴趣小组在“探究溴水与氯化亚铁溶液反应”的实验中发现:在足量的稀氯化亚铁溶液中,加入1—2滴溴水,振荡后溶液呈黄色。查阅资料显示:溴
ClO2是一种消毒杀菌效率高 二次污染小的水处理剂。实验室可通过以下反应制得ClO2: 2KClO3
ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2: 2KClO3+H2C2O4+H2SO42ClO2↑+K2SO4+2CO2↑+2H2O下列说法正确的
据悉 奥运会上使用的发令枪所用的“火药”成分是氯酸钾和红磷 经撞击发出响声 同时产生白色烟雾。撞击时
据悉,奥运会上使用的发令枪所用的“火药”成分是氯酸钾和红磷,经撞击发出响声,同时产生白色烟雾。撞击时发生的化学方程式为: 5KClO3 + 6P=3P2O5
催化反硝化法可治理水中硝酸盐的污染 该方法是用H2将NO3-还原为N2 反应的化学方程式为:5H2+
催化反硝化法可治理水中硝酸盐的污染,该方法是用H2将NO3-还原为N2,反应的化学方程式为:5H2+ 2 NO3-xOH-+ N2+4H2O。下列有关说法正确的是A.该反应
I.根据反应3Cu+8HNO3 3Cu(NO3)2+2NO↑+4H2O 回答下列问题:(1)氧化剂
I 根据反应3Cu+8HNO33Cu(NO3)2+2NO↑+4H2O,回答下列问题:(1)氧化剂是 ,元素被氧化;(2)用“双线桥”表示该反应电子转移的方向和数目:3Cu+8H












