将10.1克过氧化钠和钠的混合物跟120.1克水充分反应后 收集到的气体体积在标准状况下为2.24L
| 将10.1克过氧化钠和钠的混合物跟120.1克水充分反应后,收集到的气体体积在标准状况下为2.24L。 (1)试分别写出过氧化钠跟水反应的离子、化学方程式 ;(2)计算原混合物中过氧化钠和氧化钠的物质的量之比,n(Na2O2):n(Na)= 。 (3)计算所得溶液的质量分数是多大?ω= 。 |
参考解答
| (1) 2Na2O2+2H2O=O2↑+4 NaOH、 2Na2O2+2H2O=O2↑+4OH-+4Na+ (2)1:1 (3)9.34℅ |
试题分析:(1)过氧化钠溶于水生成氢氧化钠和氧气,反应的化学方程式和离子方程式分别是2Na2O2+2H2O=O2↑+4 NaOH、2Na2O2+2H2O=O2↑+4OH-+4Na+。 (2)设过氧化钠和钠的物质的量分别是x和y,则78g/mol×x+23g/mol×y=10.1g。由方程式可知 2Na2O2+2H2O=O2↑+4 NaOH 2 2 1 4 x x 0.5x 2x 2Na+2H2O=H2↑+2NaOH 2 2 1 2 y y 0.5y y 所以0.5x+0.5y= 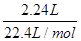 =0.1mol =0.1mol由78g/mol×x+23g/mol×y=10.1g可知x=y=0.1mol 原混合物中过氧化钠和氧化钠的物质的量之比,n(Na2O2):n(Na)=1:1。 (3)根据(2)中可知生成的氢氧化钠是2x+y=0.3mol 氢氧化钠的质量=0.3mol×40g/mol=12g 溶液的质量=10.1g+120.1g-0.05mol×32g/mol-0.05mol×2g/mol=128.5g 所以反应后溶液的质量分数ω= 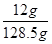 ×100%=9.34℅。 ×100%=9.34℅。 |
相似问题
将含1 mol Na和1 mol Al的合金加入足量的水中 下列描述不正确的是 ( )A.
将含1 mol Na和1 mol Al的合金加入足量的水中,下列描述不正确的是 ()A.金属Al无剩余B.c(Na+)=c(AlO-2)C.生成气体为2 molD.c(Na+)=c(Al3+)
Na2O和Na2O2的下列叙述中正确的是 ( )A
Na2O和Na2O2的下列叙述中正确的是 ( )A.Na2O比Na2O2稳定B.均可与水反应 C.均可与CO2发生化合反应D.均是典型的碱性氧化物
一定量碳酸氢钠与过氧化钠的混合物在密闭体系中充分加热后 排出气体 固体残留物组成不可能是( )A.
一定量碳酸氢钠与过氧化钠的混合物在密闭体系中充分加热后,排出气体,固体残留物组成不可能是()A.NaOH和Na2CO3B.Na2O2、NaOH和Na2CO3C.NaOHD.Na2CO3
把xmLCO2通过足量的Na2O2后再与ymLNO混合 x与y之和为30mL。设充分反应后气体的体积
把xmLCO2通过足量的Na2O2后再与ymLNO混合,x与y之和为30mL。设充分反应后气体的体积缩小为15mL,则x:y为①1:1②2:1③5:4④7:5A.①B.②C.①②D.①②③④
(1)向一小烧杯中分别加入等体积的水和煤油 片刻后再向该烧杯中轻缓地加入一粒绿豆大小的金属钠 观察到
(1)向一小烧杯中分别加入等体积的水和煤油,片刻后再向该烧杯中轻缓地加入一粒绿豆大小的金属钠,观察到的现象正确的是________________。A B C D(












