(12分)甲 乙两个探究性学习小组 他们拟测定过氧化钠样品(含少量Na2O)的纯度。(1)甲组同学
(12分)甲、乙两个探究性学习小组,他们拟测定过氧化钠样品(含少量Na2O)的纯度。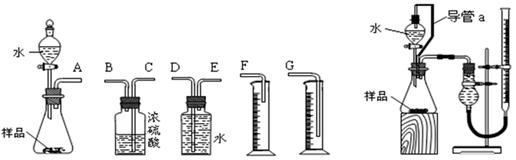 (1)甲组同学拟选用左图实验装置完成实验: ①写出实验中所发生反应的化学方程式_____________________________________________ ②该组同学必须选用的装置的连接顺序是:A接( )( )接( )( )接( )(填接口字母,可不填满。) ③实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其旋塞,一会儿后水也不能顺利滴入锥形瓶。请你帮助分析原因: _____________________________________ __。 ④实验结束时,该组同学应怎样测量实验中生成的氧气的体积? 。 (2)乙组同学仔细分析甲组同学的实验装置后,认为:水滴入锥形瓶中,即使不生成氧气,也会将瓶内空气排出,使所测氧气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氧气体积偏小。于是他们设计了右图所示的实验装置。 ①装置中导管a的作用是:____________________________、_________ 。 ②若实验中样品的质量为wg,实验前后碱式滴定管中液面读数分别为V1、V2 (换算成标况)。则样品的纯度为____________________________(含w、V的表达式)。 |
参考解答
| (12分)(1)①2Na2O2+2H2O===4NaOH+O2↑;(1分) Na2O+H2O='==2NaOH' (1分) ②EDG (2分) ③样品与水反应激烈,放热且生成气体,使锥形瓶中气体压强变大(2分) ④待实验装置冷却后,上下移动量筒,使其中液面与广口瓶中液面相平,再平视读取量筒中水的体积,即氧气的体积。(2) (2)①使分液漏斗内气体压强与锥形瓶内气体压强相等,打开分液漏斗旋塞时水能顺利滴下;滴入锥形瓶的水的体积等于进入分液漏斗的气体体积,从而消除由于加入水引起的氧气体积误差。(2) ② 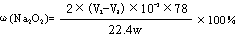 (2分) (2分) |
| (1)①氧化钠和过氧化钠都易和水反应,方程式分别是2Na2O2+2H2O=4NaOH+O2↑、Na2O+H2O=2NaOH。 ②甲组的实验原理是通过测量过氧化钠生成的氧气体积,来计算过氧化钠的质量,因此正确的顺序是AEDG。 ③由于样品与水反应激烈,放热且生成气体,使锥形瓶中气体压强变大,因而水不易滴下。 ④再测量氧气的体积时,必须保证容器内外压强是相同的,所以正确的操作是待实验装置冷却后,上下移动量筒,使其中液面与广口瓶中液面相平,再平视读取量筒中水的体积,即氧气的体积。 (2)①根据装置的结构可知,导管a可以使分液漏斗内气体压强与锥形瓶内气体压强相等,打开分液漏斗旋塞时水能顺利滴下;滴入锥形瓶的水的体积等于进入分液漏斗的气体体积,从而消除由于加入水引起的氧气体积误差。 ②根据滴定管的读数可知,生成的氧气体积是(V2-V1)ml,所以样品中过氧化钠的质量是 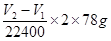 ,所以样品的纯度是 ,所以样品的纯度是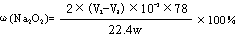 。 。 |
相似问题
将10.1克过氧化钠和钠的混合物跟120.1克水充分反应后 收集到的气体体积在标准状况下为2.24L
将10 1克过氧化钠和钠的混合物跟120 1克水充分反应后,收集到的气体体积在标准状况下为2 24L。(1)试分别写出过氧化钠跟水反应的离子、化学方程式;(2
将含1 mol Na和1 mol Al的合金加入足量的水中 下列描述不正确的是 ( )A.
将含1 mol Na和1 mol Al的合金加入足量的水中,下列描述不正确的是 ()A.金属Al无剩余B.c(Na+)=c(AlO-2)C.生成气体为2 molD.c(Na+)=c(Al3+)
Na2O和Na2O2的下列叙述中正确的是 ( )A
Na2O和Na2O2的下列叙述中正确的是 ( )A.Na2O比Na2O2稳定B.均可与水反应 C.均可与CO2发生化合反应D.均是典型的碱性氧化物
一定量碳酸氢钠与过氧化钠的混合物在密闭体系中充分加热后 排出气体 固体残留物组成不可能是( )A.
一定量碳酸氢钠与过氧化钠的混合物在密闭体系中充分加热后,排出气体,固体残留物组成不可能是()A.NaOH和Na2CO3B.Na2O2、NaOH和Na2CO3C.NaOHD.Na2CO3
把xmLCO2通过足量的Na2O2后再与ymLNO混合 x与y之和为30mL。设充分反应后气体的体积
把xmLCO2通过足量的Na2O2后再与ymLNO混合,x与y之和为30mL。设充分反应后气体的体积缩小为15mL,则x:y为①1:1②2:1③5:4④7:5A.①B.②C.①②D.①②③④












