我国北方有许多盐湖 湖水中溶有大量的Na2CO3和NaCl 那里的人们冬天捞碱(Na2CO3) 夏
我国北方有许多盐湖,湖水中溶有大量的Na2CO3和NaCl,那里的人们冬天捞碱(Na2CO3), 夏天晒盐(NaCl)。Na2CO3和NaCl的溶解度曲线如下图所示。据图回答下列问题: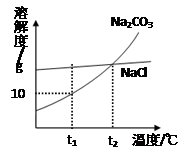 (1)t1℃时,溶解度较大的物质是__ ①______。 (2)t1℃时把10g Na2CO3固体放入100g水中,充分溶解后,可制得__②___的碳酸钠溶液(填“饱和”或“不饱和”)。 (3)人们冬天捞碱的原因是___ ③____________。 (4)将3克 NaCl固体配成15%的NaCl溶液,需要加水 ④ mL(水的密度为1g/cm3)。在用量筒量取水的体积时,如采用右图所示的方法读取数据(其它操作均正确),则所得溶液中溶质的质量分数 ⑤ 15%(选填“<”、“>”或“=”)。  |
参考解答
| (1) ①NaCl , (2) ②饱和 , (3) ③纯碱的溶解度受温度的影响变化较大 , (4)④ 17, ⑤<。 |
| (1)有两物质的溶解度曲线可知,在t1℃时,氯化钠的溶解度大于硝酸钾的溶解度,故答案为:氯化钠 (2)由于在t1℃时,碳酸钠的溶解度是10g,即在100克水中最多溶解10g碳酸钠,因此t1℃时把10g Na2CO3固体放入100g水中,形成的是饱和溶液,故答案为:饱和 (3)由于碳酸钠的溶解度随温度的降低而减小,且受温度的影响很大,因此冬天捞碱,故答案为:碳酸钠溶解度随温度降低而明显降低,冬天温度低,溶解在水中的碳酸钠就析出所以冬天可捞碱 (4)由于溶液在加水稀释的过程中溶质的质量不变,而且加入水的质量就是稀浓溶液质量之差,因此若将75克20%的NaCl溶液稀释成15%的NaCl溶液,因此需加水:75g×20%/15%/- 75g/1g/mL=25mL;由于仰视时量取的水要比实际需要的水的体积要大,即水量多了,因此所得溶液中溶质的质量分数偏小;故答案为:25,偏小 |
相似问题
(6分)KNO3 NaCl溶液在生产 生活中起着十分重要的作用。右图是它们的溶解度曲线 下表是它们在
(6分)KNO3、NaCl溶液在生产、生活中起着十分重要的作用。右图是它们的溶解度曲线,下表是它们在不同温度时的溶解度。(1)以上两种物质溶解度的变化受
右图所示曲线分别表示X Y Z三种物质的溶解度曲线。下列说法中错误的是 A.t2℃时 X和Y两种物质
右图所示曲线分别表示X、Y、Z三种物质的溶解度曲线。下列说法中错误的是A.t2℃时,X和Y两种物质的饱和溶液溶质质量分数相同B.t1℃时,三种物质溶解度从
下表是KNO3 NaCl在不同温度下的溶解度.温度(℃)0102030405060708090100
下表是KNO3、NaCl在不同温度下的溶解度.温度(℃)0102030405060708090100KNO313 320 93245 86485 5110138169202245NaCl35 735 83636 336 63737 337 838
欲将20℃时的硝酸钠不饱和溶液转变为饱和溶液 可以采取的方法是 ( )。A.升高温度B.加入水C.
欲将20℃时的硝酸钠不饱和溶液转变为饱和溶液,可以采取的方法是 ()。A.升高温度B.加入水C.加入固体硝酸钠D.倒掉一半溶液
(10福建省晋江12.)溶解度曲线为我们定量描述物质的溶解性强弱提供了便利。请你根据下图的溶解度曲线
(10福建省晋江12 )溶解度曲线为我们定量描述物质的溶解性强弱提供了便利。请你根据下图的溶解度曲线判断下列说法,其中正确的是A.20℃时,甲物质的溶解












