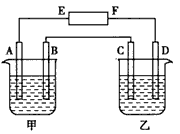
在下图中 甲烧杯中盛有100 mL0.50 mol·L-1 AgNO3溶液 乙烧杯中盛有100 mL
| 在下图中,甲烧杯中盛有100 mL0.50 mol·L-1 AgNO3溶液,乙烧杯中盛有100 mL 0.25 mol·L-1 CuCl2溶液,A、B、C、D 均为质量相同的石墨电极,如果电解一段时间后,发现A极比C 极重1.9g,则 |
|
| (1)电源E为_________ 极,F为___________ 极。 (2)A极的电极反应式为_________,析出物质__________ mol。 (3)B极的电极反应式为_________,析出气体__________ mL(标准状况)。 (4)C极的电极反应式为________,析出物质___________ mol。 (5)D极的电极反应式为________,析出气体___________ mL(标准状况)。 (6)甲烧杯中滴入石蕊试液,_________极附近变红,如果继续电解,在甲烧杯中最终得到________溶液。 |
参考解答
| (1)负 ;正 (2)4Ag+ +4e- ==4Ag ;0.025 (3)4OH--4e-==2H2O+O2 ;140 (4)Cu2+ +2e-==Cu ;0.0125 (5)2Cl- -2e-==Cl2↑ ;280 (6)B ;HNO3 |
相似问题
图1是在金属锌板上贴上一张用某溶液浸湿的滤纸 图2是NaBH4/H2O2燃料电池 则下列说法不正确的
图1是在金属锌板上贴上一张用某溶液浸湿的滤纸,图2是NaBH4 H2O2燃料电池,则下列说法不正确的是 [ ]A.图2电池放电过程中,Na+向正极迁移 B.图2电池
采用惰性电极从NO3- SO42- Cl- Cu2+ Ba2+ Ag+ H+选出适当离子组成的电解质
采用惰性电极从NO3-、SO42-、Cl-、Cu2+、Ba2+、Ag+、H+选出适当离子组成的电解质(非熔融态下),并电解(填化学式)(1)若两极分别放出H2和O2,电解质
铝和氢氧化钾都是重要的工业产品。请回答(1)工业冶炼铝的化学方程式是________________
铝和氢氧化钾都是重要的工业产品。请回答(1)工业冶炼铝的化学方程式是__________________________________。(2)铝与氢氧化钾溶液反应的离子方程式是_
电解质量分数为0.052(5.2%)的NaOH溶液1 L(密度为1.06 g/cm3) 用铂作电极电
电解质量分数为0 052(5 2%)的NaOH溶液1 L(密度为1 06 g cm3),用铂作电极电解,当溶液中NaOH的质量分数改变了0 010(1 0%)时停止电解,此时溶液中符合下
用惰性电极电解下列溶液 一段时间后 再加入一定量的另一种物质(括号内物质) 电解液基本不变的是[
用惰性电极电解下列溶液,一段时间后,再加入一定量的另一种物质(括号内物质),电解液基本不变的是[ ]A.CuCl2(CuSO4) B.NaOH(NaOH) C.NaCl(HCl) D.CuSO4[Cu(OH)2]