(12分)回答下列问题(1)CH4 CO2 COCl2和四种分子中 碳原子为sp2杂化的分子是___
| (12分)回答下列问题 (1)CH4、CO2、COCl2和 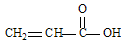 四种分子中,碳原子为sp2杂化的分子是_______________________________________________。 四种分子中,碳原子为sp2杂化的分子是_______________________________________________。(2)NH3分子的立体构型是___________形,联氨(N2H4)可视为是NH3分子中的一个氢原子被氨基(-NH2)取代所形成的物质,写出联氨加入足量盐酸反应的化学方程式_________________________________________________________________。 (3)H2O、H2O2、OF2和SCl2四种分子中各原子均达8电子结构的分子是________________。 (4)N2H4与H2O2反应:N2H4(l)+2H2O2=N2(g)+4H2O(g) ,若该反应中有4 mol N—H键断裂,则形成  键有_______mol和形成 键有_______mol和形成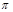 键有_______mol。 键有_______mol。(5)H2O熔沸点都比H2S高,其原因是___________________________________________。 |
参考解答
(1) COCl2、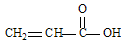 (各1分) (各1分)(2) 三角锥(1分) N2H4+2HCl=N2H6Cl2(3分) (3) OF2、SCl2(各1分) (4) 9 2(各1分) (5) H2O分子间形成了氢键(2分) |
| (1)甲烷是正四面体型结构,碳原子是sp3杂化。CO2是直线型结构,碳原子是sp杂化。丙烯酸和COCl2中碳原子全部形成1个双键和2个单键,所以是sp2杂化。 (2)氨气中的氮原子含有1对孤对电子,所以是三角锥形。由于联氨(N2H4)可视为是NH3分子中的一个氢原子被氨基(-NH2)取代所形成的物质,所以联氨能形成配位键,方程式为N2H4+2HCl=N2H6Cl2。 (3)只有元素的化合价的绝对值和该原子的最外层电子数之和满足8,才能达到8电子稳定结构,所以只有OF2和SCl2分子中各原子均达8电子结构。 (4)反应中有4 mol N—H键断裂,则必然生成1mol氮气和4mol水,所以可以形成9mol  键,和2mol 键,和2mol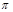 键。 键。(5)水分子中含有氢键,所以沸点高于H2S的沸点。 |
相似问题
下列物质中 只含有离子键 不含有共价键的是A.HClB.KOHC.CaCl2D.CO2
下列物质中,只含有离子键,不含有共价键的是A.HClB.KOHC.CaCl2D.CO2
(11分)(1)氢气是一种清洁能源 氢气的制取与储存是氢能源利用领域的研究热点。已知: CH4(g)
(11分)(1)氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。已知: CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206 2kJ·mol-1CH4(g)+CO
(14分) 能源短缺是人类面临的重大问题。甲醇是一种可再生能源 具有广泛的开发和应用前景。(1)工业
(14分) 能源短缺是人类面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。(1)工业上一般采用下列两种反应合成甲醇:反应I:CO2(g)+3H
下列分子中键与键数之比为3∶1的是( )A.N2B.C2H4C.HCHOD.HCN
下列分子中键与键数之比为3∶1的是()A.N2B.C2H4C.HCHOD.HCN
氮化硼是一种超硬耐磨 耐高温 抗腐蚀的物质。下列各组物质熔化时所克服的微粒间的作用力类型与氮化硼熔化
氮化硼是一种超硬耐磨、耐高温、抗腐蚀的物质。下列各组物质熔化时所克服的微粒间的作用力类型与氮化硼熔化时相同的是( )A.硝酸钠和金刚石B.冰和干












