(14分) 能源短缺是人类面临的重大问题。甲醇是一种可再生能源 具有广泛的开发和应用前景。(1)工业
| (14分) 能源短缺是人类面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。(1)工业上一般采用下列两种反应合成甲醇: 反应I:CO2(g)+3H2(g) 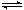 CH3OH(g)+H2O(g)ΔH1 反应II:CO(g)+2H2(g) CH3OH(g)+H2O(g)ΔH1 反应II:CO(g)+2H2(g)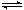 CH3OH(g) ΔH2 CH3OH(g) ΔH2①上述反应符合“原子经济”原则的是 (填“Ⅰ”或“Ⅱ”), ②下表所列数据是反应Ⅱ在不同温度下的化学平衡常数(K)的变化
Ⅱ.若容器容积不变,下列措施可增加甲醇产率的是 , A.升高温度 B.将CH3OH(g)从体系中分离 C.使用合适的催化剂 D.充入He,使体系总压强增大 E.按原比例再充入 CO和 H2 Ⅲ.某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)="0.2" mol·L-1,则CO的转化率为 ,此时的温度为 (从上表中选择); 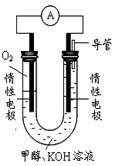 (2)某实验小组依据甲醇燃烧的反应原理,设计如上图所示的原电池装置。 ①该电池工作时,OH-向_______极移动(填“正”或“负”), ②该电池负极的电极反应为 。 |
参考解答
| 考查绿色化学的思想、外界条件对平衡的影响以及电化学的应用等。 (1)①Ⅱ ② I.< Ⅱ.BE Ⅲ.80% 250℃(2)① 负 ②CH3OH +8OH-— 6e- = CO32- + 6H2O |
| (1)原子利用率达到100%的即符合绿色化学原则,所以反应Ⅱ符合“原子经济”原则;根据表中数据可判断,随着温度的升高,平衡常数逐渐减小,说明升高温度平衡向逆反应方向移动,所以正反应是放热反应,即△H<0;升高温度平衡向逆反应方向移动,生成物的产率降低,A不正确。B相当于降低生成物浓度,平衡向逆反应方向移动,增大产率,正确。催化剂只影响反应速率,不影响平衡状态,C不正确。D只压强增大,但反应物的浓度并没有增大,平衡不移动,不正确。E相当于增大反应物的浓度平衡平衡向正反应方向移动,产率增大。 (2)原电池中负极失去电子,经导线传递到正极上,正极得到电子,所以溶液中的阳离子向正极移动,而阴离子向负极移动。根据燃料电池的装置图可判断通入氧气的电极是正极,甲醇在负极通入,由于电解质是氢氧化钾溶液显强碱性,所以甲醇的氧化产物是碳酸钾和水。 |
相似问题
下列分子中键与键数之比为3∶1的是( )A.N2B.C2H4C.HCHOD.HCN
下列分子中键与键数之比为3∶1的是()A.N2B.C2H4C.HCHOD.HCN
氮化硼是一种超硬耐磨 耐高温 抗腐蚀的物质。下列各组物质熔化时所克服的微粒间的作用力类型与氮化硼熔化
氮化硼是一种超硬耐磨、耐高温、抗腐蚀的物质。下列各组物质熔化时所克服的微粒间的作用力类型与氮化硼熔化时相同的是( )A.硝酸钠和金刚石B.冰和干
(11分)A B C D是四种短周期元素 它们的原子序数依次增大。其中A D元素同主族 B C元素同
(11分)A、B、C、D是四种短周期元素,它们的原子序数依次增大。其中A、D元素同主族,B、C元素同周期;由A、B、C、D中的两种元素可形成原子个数比为1:1的多
下列变化既有化学键的破坏又有化学键的形成的是( )A.碘升华B.冰融化C.浓盐酸挥发D.NH4Cl
下列变化既有化学键的破坏又有化学键的形成的是()A.碘升华B.冰融化C.浓盐酸挥发D.NH4Cl受热分解
下列变化过程中 无化学键断裂或生成的是 A.石墨转化为金刚石B.NaCl晶体溶于水C.干冰升华D.
下列变化过程中,无化学键断裂或生成的是 A.石墨转化为金刚石B.NaCl晶体溶于水C.干冰升华D.HCl溶于水












