已知A B C D E都是周期表中前四周期的元素 它们的核电荷数依次增大.其中A原子核外有三个未成对
| 已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增大.其中A原子核外有三个未成对电子;A与B可形成离子化合物B3A2;C元素是地壳中含量最高的金属元素;D原予核外的M层中有两对成对电子;E原子核外最外层只有1个电子,其余各层电子均充满.请根据以上信息,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示) (1)E的核外电子排布式是______,A、B、C、D的第一电离能由小到大的顺序为______. (2)B的氯化物的熔点远高于C的氯化物的熔点,理由是______; (3)A的最高价含氧酸根离子中,其中心原子采取______杂化,D的低价氧化物分子的空间构型是______. (4)A、E形成某种化合物的晶胞结构如下图所示,则其化学式为______;(每个球均表示1个原子) 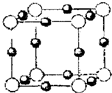 |
参考解答
| C元素是地壳中含量最高的金属元素,所以C是Al元素,D原予核外的M层中有两对成对电子,且D的原子序数大于C,所以D是S元素,E原子核外最外层只有1个电子,其余各层电子均充满,且E是前四周期的元素,E的原子序数大于16,所以Cu元素,A原子核外有三个未成对电子,且原子序数小于13,所以A是N元素,A与B可形成离子化合物B3A2,且B的原子序数大于A小于C,所以B是Mg元素. (1)E的原子序数是29,为Cu元素,其原子核外电子排布式为:1s22s22p63s23p63d104s1,Mg、Al、S元素是同一周期元素,同一周期元素的第一电离能逐渐增大,但镁的第一电离能大于铝的第一电离能,同一主族的第一电离能随着原子序数的增大而减小,所以N元素的第一电离能大于P元素,P元素第一电离能大于S元素,所以Mg、Al、S、N元素的第一电离能由小到大的顺序为Al<Mg<S<N, 故答案为:1s22s22p63s23p63d104s1,Al<Mg<S<N; (2)氯化镁是离子晶体,氯化铝是分子晶体,所以离子晶体的熔点远大于分子晶体的熔点,故答案为:氯化镁是离子晶体,氯化铝是分子晶体; (3)NO3-中价层电子对=3+
故答案为:sp2,V形; (4)该晶胞中白色球个数=
|
相似问题
U V W X Y Z六种原子序数依次增大前20号元素 其中U和X W和Y分别在同一主族 Y的原子序
U、V、W、X、Y、Z六种原子序数依次增大前20号元素,其中U和X,W和Y分别在同一主族,Y的原子序数是W的原子序数两倍,Z的原子序数是U和X的原子序数之和.根
X和Y是原子序数大于4的短周期元素 Xm+和Yn-两种离子的核外电子排布相同 下列说法中正确的是(
X和Y是原子序数大于4的短周期元素,Xm+和Yn-两种离子的核外电子排布相同,下列说法中正确的是( )A.X的原子半径比Y小B.X和Y的核电荷数之差为m-nC.
某元素的最外层有2个电子 该元素( )A.一定是金属元素B.最高化合价一定为+2价C.一定是ⅡA族
某元素的最外层有2个电子,该元素( )A.一定是金属元素B.最高化合价一定为+2价C.一定是ⅡA族元素或是HeD.无法确定属于哪类元素
A 元素的原子最外层电子数是a 次外层电子数是b B 元素的原子 M 层电子数是(a-b) L 层电
A元素的原子最外层电子数是a,次外层电子数是b,B元素的原子M层电子数是(a-b),L层电子数是(a+b),则A、B两种元素形成的化合物的化学式和形成晶体的
X Y Z M W为五种短周期元素.X Y Z是原子序数依次递增的同周期元素 且最外层电子数之和为1
X、Y、Z、M、W为五种短周期元素.X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况












