下图是元素周期表中的前四周期 ①~⑨为相应的元素 请从中选择合适的元素回答问题(1)根据元素原子的外
| 下图是元素周期表中的前四周期,①~⑨为相应的元素,请从中选择合适的元素回答问题 |
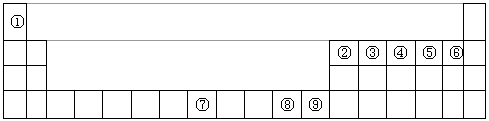 |
| (1)根据元素原子的外围电子排布特征,元素周期表可划分为五个区域,①元素位于周期表的________区。 (2)②、⑥两元素形成的化合物的空间构型为________,其中心原子的杂化轨道类型为________。 (3)写出元素⑧基态原子的电子排布式________________。 (4)⑧的二价阳离子与过量的④的氢化物的水化物作用的离子方程式为:________________________。 (5)元素⑦与CO可形成的X(CO)5型化合物,该化合物常温下呈液态,熔点为-20.5℃,沸点为 103℃,易溶于非极性溶剂,据此可判断该化合物晶体属于________晶体(填晶体类型)。 (6)元素⑨的离子的氢氧化物不溶于水,但可溶于氨水中,该离子与NH3间结合的作用力为________。 (7)金属⑦的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。则面心立方晶胞和体心立方晶胞中实际含有的原子个数之比为________。 |
 |
参考解答
| (1)s (2)平面正三角形;sp2杂化 (3)1s22s22p63s23p63d104s1或 [Ar 3d104s1 (4)Cu2++4NH3=[Cu(NH3)42+ (5)分子晶体 (6)配位键 (7)2:1 |
相似问题
下列说法正确的是( )A.P4和CH4都是正四面体分子且键角都为109.5°B.SF6和PCl3分
下列说法正确的是( )A.P4和CH4都是正四面体分子且键角都为109 5°B.SF6和PCl3分子中所有原子最外层电子都满足8电子稳定结构C.NH4+的电子式为,离
试总结第二周期元素Be B C N O F生成共价键的规律性 并填入下表中。
试总结第二周期元素Be、B、C、N、O、F生成共价键的规律性,并填入下表中。
三氟化氮是一种无色 无味 无毒且不可燃的气体 在半导体加工 太阳能电池和液晶显示器的制造中得到广泛应
三氟化氮是一种无色、无味、无毒且不可燃的气体,在半导体加工,太阳能电池和液晶显示器的制造中得到广泛应用。NF3是一种三角锥型分子,键角102°,沸点-
乙炔是有机合成工业的一种原料。工业上曾用CaC2与水反应生成乙炔。(1) CaC2中C22-与O22
乙炔是有机合成工业的一种原料。工业上曾用CaC2与水反应生成乙炔。(1) CaC2中C22-与O22+互为等电子体,O22+的电子式可表示为_________;1mol O22+中含
某研究所合成了一种球形分子 它的分子式为C60Si60 其结构中包含有C60和Si60结构。下列对该
某研究所合成了一种球形分子,它的分子式为C60Si60,其结构中包含有C60和Si60结构。下列对该分子的叙述中正确的是A.分子中Si60被包裹在C60里面B.形成的












