已知A B C D E F都是短周期的元素 它们的原子序数依次递增.A原子的电子层数与它的核外电子总
| 已知A、B、C、D、E、F都是短周期的元素,它们的原子序数依次递增.A原子的电子层数与它的核外电子总数相同,而B原子的最外层电子数是次外层的2倍,C的氢化物可使湿润的红色石蕊试纸变蓝,B和D可以形成两种气态化合物,E原子核外电子总数比B的2倍少1,F在本周期元素中原子半径最小.则: (1)A、B、C、D、E、F的名称分别是______. (2)在A至F中任选元素,写出二种含极性键的非极性分子的结构式______,写出一种含非极性键的离子化合物的电子式______. (3)由B和D组成,且B和D的质量比为3:8的化合物的电子式是______,该物质与E的同周期相邻主族元素的单质反应的化学方程式为______ (4)F单质与E的最高价氧化物的水化物反应的离子方程式为______. (5)将8g BA4完全燃烧后恢复到室温,放出热量a kJ,写出表示BA4的燃烧热的热化学方程式______. |
参考解答
| (3)A原子的电子层数与它的核外电子总数相同,应为H元素,B原子的最外层电子数是次外层的2倍,应为C元素,C的氢化物可使湿润的红色石蕊试纸变蓝,应为N元素,形成的氢化物为氨气,为碱性气体,B和D可以形成两种气态化合物,应分别为CO和CO2,则D为O元素,E原子核外电子总数比B的2倍v3,则E的原子序数为33,应为Na元素,A、B、C、D、E、F都是短周期的元素,它们的原子序数依次递增,且F在本周期元素中原子半径最小,应为Cl元素, 所以A、B、C、D、E、F的名称分别是氢、碳、氮、氧、钠、氯, 故答案为:氢、碳、氮、氧、钠、氯; (2)在A至F中任选元素,含极性键的非极性分子有等CO2、CH4、CCl4,对应结构式分别为O=C=O、 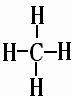 、 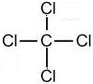 ,含非极性键的离子化合物为Na2O2,电子式为 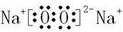 , 故答案为:O=C=O、 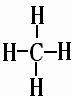 、  (任写两种); 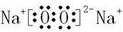 ; (3)由C和O组成,且C和O的质量比为3:个的化合物为CO2,电子式为 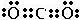 ,与Na的同周期相邻主族元素为Mg,二者反应的化学方程式为CO2+2Mg
故答案为: 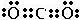 ;CO2+2Mg
(4)Cl2与NaOH溶液反应生成NaClO和水,反应的离子方程式为2OH-+Cl2=Cl-+ClO-+H2O, 故答案为:2OH-+Cl2=Cl-+ClO-+H2O; (a)n(CH4)=
故答案为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-2akJ/mol. |
相似问题
A元素原子的L层比B元素原子的L层少3个电子 B元素原子核外电子数比A元素原子核外电子总数多5个 则
A元素原子的L层比B元素原子的L层少3个电子,B元素原子核外电子数比A元素原子核外电子总数多5个,则A、B两元素形成的化合物可表示为( )A.BA2B.BA3C.A3B2D.B3A2
下表所示为部分短周期元素的原子半径及主要化合价 根据表中信息判断以下叙述正确的是( )元素代号AB
下表所示为部分短周期元素的原子半径及主要化合价,根据表中信息判断以下叙述正确的是( )元素代号ABCDE原子半径 nm0 1600 1430 1020 0710 099主要化
A B C D四种元素的原子序数依次增大 且均小于18.B C元素原子的最外层电子数之和等于D元素原
A、B、C、D四种元素的原子序数依次增大,且均小于18.B、C元素原子的最外层电子数之和等于D元素原子的最外层电子数,A、C同主族且C元素原子的核外电子数
短周期元素W X Y和Z的原子序数依次增大。元素W是制备一种高效电池的重要材料 X原子的最外层电子数
短周期元素W、X、Y和Z的原子序数依次增大。元素W是制备一种高效电池的重要材料,X原子的最外层电子数是内层电子数的2倍,元素Y是地壳中含量最丰富的金属
人们常将在同一原子轨道上运动的 自旋方向相反的2个电子 称为“电子对”;将在同一原子轨道上运动的单个
人们常将在同一原子轨道上运动的、自旋方向相反的2个电子,称为“电子对”;将在同一原子轨道上运动的单个电子,称为“未成对电子”。以下有关主族元素原












