A B C三种元素的原子具有相同的电子层数 而B的核电荷数比A大2 C原子的电子总数比B原子电子总数
| A、B、C三种元素的原子具有相同的电子层数,而B的核电荷数比A大2,C原子的电子总数比B原子电子总数多4.1molA单质跟盐酸反应可置换出11.2L(标准状况下)氢气,这时A转变成与氖原子具有相同电子层结构的离子.试回答: (1)A是______元素,B是______元素,C是______元素. (2)写出A元素的单质在氧气燃烧时生成物的电子式:______. (3)写出由A元素和C元素组成化合物的形成过程:______. (4)分别写出A、B最高价氧化物对应水化物分别跟C的气态氢化物水溶液反应的离子方程式:______. (5)A离子的氧化性比B离子的氧化性______,这是由于______. |
参考解答
| A、B、C三种元素的原子具有相同的电子层数,则在同一周期,1molA单质跟盐酸反应可置换出11.2L(标准状况下)氢气,设A的化合价为x, 由电子守恒可知,1mol×x=
再根据B的核电荷数比A大2,B为Al,C原子的电子总数比B原子电子总数多4,C为Cl, (1)由上述推导可知,A为Na,B为Al,C为Cl,故答案为:Na;Al;Cl; (2)Na在氧气中燃烧生成过氧化钠,其电子式为 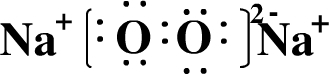 ,故答案为: 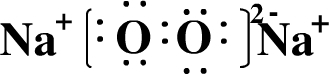 ; (3)A元素和C元素组成化合物为NaCl,为离子化合物,其形成过程为  , 故答案为:  ; (4)A、B最高价氧化物对应水化物分别为NaOH、Al(OH)3,C的气态氢化物为HCl,分别反应的离子反应为OH-+H+═H2O、Al(OH)3+3H+═Al3++3H2O, 故答案为:OH-+H+═H2O、Al(OH)3+3H+═Al3++3H2O; (5)金属性Na>Al,还原性Na>Al,则A离子的氧化性比B离子的氧化性弱,故答案为:弱;A单质的还原性强或A元素的金属性强. |
相似问题
下列原子的价电子排布正确的是[ ]A.N B.O C.C D.F
下列原子的价电子排布正确的是[ ]A.N B.O C.C D.F
有A B C D E五种短周期元素 其元素特征信息如下表:元素编号元素特征信息A其单质是密度最小的物
有A、B、C、D、E五种短周期元素,其元素特征信息如下表:元素编号元素特征信息A其单质是密度最小的物质B其阴离子带两个单位的负电荷,单质是空气主要成分
X Y Z三种元素原子具有相同的电子层数 x的最高价氧化物对应水化物呈碱性 Y的最高价氧化物对应水化
X、Y、Z三种元素原子具有相同的电子层数,x的最高价氧化物对应水化物呈碱性,Y的最高价氧化物对应水化物呈酸性,而z的最高价氧化物对应水化物呈两性,则
由短周期元素构成的某离子化合物X中 一个阳离子和一个阴离子核外电子数之和为20.则有关X的下列说法中
由短周期元素构成的某离子化合物X中,一个阳离子和一个阴离子核外电子数之和为20.则有关X的下列说法中正确的是( )A.X中阳离子和阴离子个数不一定
A B是两种同主族元素的原子 当它们都获得2个电子形成稳定结构的阴离子时 A放出的能量大于B 由此可
A、B是两种同主族元素的原子,当它们都获得2个电子形成稳定结构的阴离子时,A放出的能量大于B,由此可知( )A.氢化物稳定性:H2A>H2BB.还原性:A2












