2012年10月8日发布的修订版《机动车驾驶证申领和使用规定》 以其对违章驾驶员的严厉惩罚被人们称为
2012年10月8日发布的修订版《机动车驾驶证申领和使用规定》,以其对违章驾驶员的严厉惩罚被人们称为“史上最严交规”,其中饮酒后驾驶机动车的一次记12分。利用如下测试管可检测司机是否酒后驾车,化学原理如下: 金属铬在化合物中主要有+3价和+6价两种价态。+6价铬化合物K2CrO4和K2Cr2O7在水溶液中分别呈黄色和橙色,它们在溶液中存在如下平衡关系:2CrO42-+2H+  Cr2O72-+H2O在酸性条件下+6价铬化合物具有强氧化性,可以将C2H5OH氧化为CH3COOH,本身被还原为Cr3+,Cr3+在水溶液中呈灰绿色。 Cr2O72-+H2O在酸性条件下+6价铬化合物具有强氧化性,可以将C2H5OH氧化为CH3COOH,本身被还原为Cr3+,Cr3+在水溶液中呈灰绿色。(1)根据上述条件可知,在强酸性条件下+6价铬主要以 (填“CrO2-4”或“Cr2O2-7”)形式存在。如果司机酒后驾车,则测试管中的现象是 且超过法定警界线,反应的离子方程式为 。 (2)研究发现+6价铬的毒性为+3价铬的毒性的100~200倍,有多种方法可以将废水中的+6价铬转化为+3价铬以降低毒性。其中两种方法如下: 方法一:电化学方法。将含Cr2O2-7的酸性废水加适量NaCl搅拌均匀并以Fe作电极进行电解。在阳极产生的Fe2+将Cr2O2-7还原为Cr3+,在电解过程中溶液的pH不断上升,最终Cr3+和Fe3+以Cr(OH)3和Fe(OH)3沉淀的形式析出。 ①请分析溶液pH不断上升的原因: 。 ②已知Fe3+和Cr3+变为Fe(OH)3和Cr(OH)3沉淀的pH如下表: 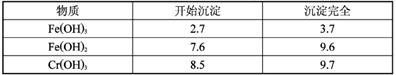 当溶液的pH范围为____时,溶液中Fe3+已沉淀完全而Cr3+还没有开始沉淀。 ③当电路中通过3mol电子时,理论可还原Cr2O2-7的物质的量为 mol。 方法二:还原沉淀法。将l0ml某含铬(Cr2O2-7)废水用硫酸亚铁铵[FeSO4·(NH4)2SO4·6H2O]处理,反应中铁元素和铬元素完全转化为沉淀,该沉淀经干燥后为nmolFeO·FeyCrxO3。 ④不考虑处理过程中的实际损耗,下列叙述错误的是
|
参考解答
| (14分) (1)Cr2O2-7;灰绿色;3C2H5OH+2 Cr2O2-7 +16H+ =3CH3COOH+4 Cr3+ +11H2O; (2)①电解时阴极消耗H+,Cr2O2-7还原为Cr3+ 也消耗H+,所以pH不断上升; ②3.7<pH< 8.5;③0.25 mol;④A |
试题分析: (1)因为在强酸性溶液中;2CrO42-+2H+  Cr2O72-+H2O平衡向右移动; Cr2O72-+H2O平衡向右移动;Cr2O2-7与C2H5OH反应生成Cr3+ 所以呈灰绿色; 根据氧化还原反应配平得 3C2H5OH+2 Cr2O2-7 +16H+ =3CH3COOH+4 Cr3+ +11H2O; (2)①电解时阴极的电极反应方程式为2H+ +2e=H2另外溶液中还发生Cr2O72- +6 Fe2++14 H+ = 2Cr3+ +6 Fe3+ +7 H2O ②3.7<pH<8.5,溶液中Fe3+已沉淀完全而Cr3+还没有开始沉淀; ③当电路中通过3mol电子时,会产生1.5mol Fe2+ ,再根据Cr2O72- +6 Fe2++14 H+ = 2Cr3+ +6 Fe3+ +7 H2O还原的Cr2O72- 为0.25mol; ④反应中发生转移的电子个数为ny; |
相似问题
(15分)某兴趣小组的同学发现 将CuSO4溶液与Na2CO3溶液混合会产生蓝绿色沉淀。他们对沉淀的
(15分)某兴趣小组的同学发现,将CuSO4溶液与Na2CO3溶液混合会产生蓝绿色沉淀。他们对沉淀的组成很感兴趣,决定采用实验的方法进行探究。Ⅰ.【提出猜想
为探究 Na Mg Al的金属活动性顺序 某课外小组同学进行了如下实验(1)他们记录的实验现象有:①
为探究 Na、Mg、Al的金属活动性顺序,某课外小组同学进行了如下实验(1)他们记录的实验现象有:①有剧烈反应,迅速生成大量的气体。 ② 浮在水面上,
为了研究外界条件对H2O2分解速率的影响 某同学做了以下实验 请回答下列问题。编号操作实验现象①分别
为了研究外界条件对H2O2分解速率的影响,某同学做了以下实验,请回答下列问题。编号操作实验现象①分别在试管A、B中加入5mL 5%H2O2溶液,各滴入2滴1 mo
下图中的实验装置可以用于实验室制取乙炔。请填空:(1) 图中A管的作用是
下图中的实验装置可以用于实验室制取乙炔。请填空:(1) 图中A管的作用是,制取乙炔的化学反应方程式为。(2)乙炔通入酸性KMnO4溶液中,发生反应,可
图Ⅰ是化学实验室中常用制备 干燥气体的部分仪器装置。某学校同学利用中学常用试剂及仪器设计下列实验。(
图Ⅰ是化学实验室中常用制备、干燥气体的部分仪器装置。某学校同学利用中学常用试剂及仪器设计下列实验。(1)图Ⅰ中仪器B的名称:_____________________












