某科研小组设计出利用工业废酸(10%H2SO4)来堆浸某废弃的氧化铜锌矿的方案 实现废物综合利用 方
某科研小组设计出利用工业废酸(10%H2SO4)来堆浸某废弃的氧化铜锌矿的方案,实现废物综合利用,方案如图所示.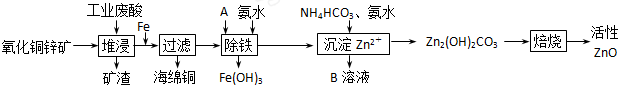 已知:各离子开始沉淀及完全沉淀时的pH如下表所示.
(1)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS不溶,则相同温度下:Ksp(CuS)______ Ksp(ZnS)(选填“>”“<”或“=”). (2)物质A可使用下列物质中的______. A.KMnO4 B.O2 C.H2O2 D.Cl2 (3)除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在______范围之间. (4)物质B可直接用作氮肥,则B的化学式是______. (5)除铁后得到的Fe(OH)3可用KClO溶液在碱性环境将其氧化得到一种高效的多功能水处理剂--K2FeO4,写出该反应的离子方程式______. |
参考解答
| (1)相同条件下,溶解度大的物质先溶解,因在H2SO4的作用下ZnS可以溶解而CuS不溶,则相同温度下:Ksp(CuS)<Ksp(ZnS),故答案为:<; (2)除铁过程中加入A和氨水,使亚铁离子变成氢氧化铁沉淀,故A应为氧化剂,考虑不引入新的杂质,应选BC,故答案为:BC; (3)从图表数据可知,铁离子沉淀完全的PH为3.2,锌离子开始沉淀的PH为6.2.故除铁PH范围为:3.2~6.2; (4)因所用废酸为硫酸,B又可作氮肥,所以B为NH4)2SO4,故答案为:(NH4)2SO4; (5)由题给信息可知,反应物为2Fe(OH)3、ClO-、OH-,生成物之一为FeO42-,因铁在反应中化合价升高,故氯的化合价降低,故另一产物为Cl-,根据元素守恒,还有水是产物.根据化合价升降法配平此方程式为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O. |
相似问题
某实验小组利用如下仪器组装一套制备氮化硼晶体的装置.反应原理是B2O3+2NH3 高温 . 2BN
某实验小组利用如下仪器组装一套制备氮化硼晶体的装置.反应原理是B2O3+2NH3高温 2BN+3H2O.(已知:BN高温下能被空气氧化,不溶于水;B2O3难溶于冷水但
某同学想通过下图装置(夹持装置已略去)实验 探究SO2与Na2O2反应的产物.Ⅰ.装置D的作用___
某同学想通过下图装置(夹持装置已略去)实验,探究SO2与Na2O2反应的产物.Ⅰ.装置D的作用______.Ⅱ.如何检验反应中是否有O2生成______.Ⅲ.对C中固
下列各组物质的水溶液不用其它试剂无法鉴别的是( )A.NaOH AlCl3B.CuSO4BaCl2
下列各组物质的水溶液不用其它试剂无法鉴别的是( )A.NaOHAlCl3B.CuSO4BaCl2C.NaAlO2HClD.MgCl2NaCl
金属钠与水的反应是中学化学中的一个重要反应.在高中化学教材的几次改版中该实验曾出现过几种不同的演示方
金属钠与水的反应是中学化学中的一个重要反应.在高中化学教材的几次改版中该实验曾出现过几种不同的演示方法,分别如图中甲、乙、丙所示:(1)现按图甲
Cu+在酸性溶液中不稳定 可发生自身氧化-还原反应生成Cu2+和Cu.现有浓硫酸 浓硝酸 稀硫酸 稀
Cu+在酸性溶液中不稳定,可发生自身氧化-还原反应生成Cu2+和Cu.现有浓硫酸、浓硝酸、稀硫酸、稀硝酸、FeCl3稀溶液及pH试纸,而没有其它试剂.简述如何用












