(12分)为除去粗盐中的Ca2+ Mg2+ Fe3+ SO42-以及泥沙等杂质 某同学设计了一种制备
(12分)为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):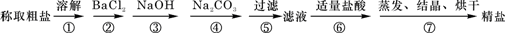 (1)第⑤步实验操作需要烧杯、____________、___________等玻璃仪器。 (2)步骤2中,判断加入BaCl2已过量的方法是: (3)除杂试剂BaCl2、NaOH、Na2CO3、加入的顺序还可以是(用化学式回答) 。 (4)若先用盐酸调pH值再过滤,将对实验结果产生影响,其原因是_____________________________。 (5)为检验精盐纯度,需配制200 mL 1 mol/L NaCl(精盐)溶液,下图是该同学转移溶液的示意图,图中的错误是: 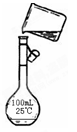 (6)配制过程中,下列操作情况会使结果偏低的是
|
参考解答
| (12分,第一题一空1分,其余每空2分) (1)玻璃棒漏斗 (2)在②步后的上层清液中,再滴入BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量(其它合理答案也可) 2分 (3)NaOH、BaCl2、Na2CO3或BaCl2、Na2CO3、NaOH 2分 (4)在此酸度条件下,会有部分沉淀溶解,从而影响制得精盐的纯度 2分 (5)未用玻璃棒引流;未用200mL容量瓶。2分 (6)AD 各1分,共2分多选、错选不得分。 |
| (1)步骤⑤是过滤,需要的玻璃仪器是烧杯、玻璃棒和漏斗。 (2)判断加入BaCl2已过量的方法是继续加入氯化钡溶液,即在②步后的上层清液中,再滴入BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量。 (3)考查物质的分离和提纯。Ca2+用碳酸钠除去,Mg2+和铁离子用氢氧化钠除去,SO42-用氯化钡除去,最后加入盐酸酸化。但用于过量的氯化钡要用碳酸钠来除,所以碳酸钠必需放在氯化钡的后面,而氢氧化钠可以随意调整,即NaOH、BaCl2、Na2CO3或BaCl2、Na2CO3、NaOH。 (4)若先用盐酸调pH值再过滤,则在此酸度条件下,会有部分沉淀溶解,从而影响制得精盐的纯度。 (5)根据示意图可知,存在的错误是未用玻璃棒引流和未用200mL容量瓶。 (6)根据c=n/V可知,称量时,托盘天平左盘加砝码,右盘加氯化钠,则溶质的质量减少,浓度偏小;移液前,容量瓶中有少量蒸馏水未倒出,不影响实验结果;定容时,俯视容量瓶刻度线观察液面,则容量瓶中溶液的体积减少,浓度偏高;定容后,倒置容量瓶摇匀经平放静置,液面低于刻度线,再加水定容,则容量瓶中溶液的体积增加,浓度偏小,所以答案选AD。 |
相似问题
以下实验装置不能用于分离物质的是
以下实验装置不能用于分离物质的是
下列各组混合物可用分液漏斗分离的一组是A.食用油和酒精B.碘和四氯化碳C.淀粉液和泥沙D.汽油和水
下列各组混合物可用分液漏斗分离的一组是A.食用油和酒精B.碘和四氯化碳C.淀粉液和泥沙D.汽油和水
下列各组液体混合物 能用分液漏斗分离的是 ( )A.酒精
下列各组液体混合物,能用分液漏斗分离的是()A.酒精和碘水B.水和苯C.液溴和苯D.乙醇和四氯化碳
(10分)(2011·锦州高一检测)目前世界上60%的镁是从海水提取的。海水提镁的主要流程如下:请
(10分)(2011·锦州高一检测)目前世界上60%的镁是从海水提取的。海水提镁的主要流程如下:请回答下列问题:(1)从离子反应的角度思考,在海水中加入石灰
能用分液漏斗分离的混合物是( )A.液溴和四氯化碳B.苯和蒸馏水C.乙醛和乙醇D.溴苯和苯
能用分液漏斗分离的混合物是()A.液溴和四氯化碳B.苯和蒸馏水C.乙醛和乙醇D.溴苯和苯












