我市充分发挥自己的区域优势 积极打造“海西铜都”。某铜业从国外进口一批含碱式碳酸铜[Cu2(OH)2
| 我市充分发挥自己的区域优势,积极打造“海西铜都”。某铜业从国外进口一批含碱式碳酸铜[Cu2(OH)2CO3]70%以上的孔雀石作原料,为检测碱式碳酸铜含量是否达到要求,技术人员取孔雀石样品30g与溶质质量分数为20%的稀硫酸反应,反应过程中产生CO2和消耗稀硫酸的情况如下图所示。 |
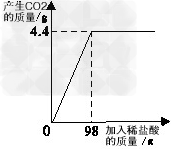 |
| [温馨提示]①反应原理是Cu2(OH)2CO3+2H2SO4==2CuSO4+3H2O+CO2↑;②孔雀石中其他 物质不与稀硫酸反应;③Cu2(OH)2CO3的相对分子质量为222。 请解答下列问题: (1)实验室常用98%的浓硫酸稀释得到稀硫酸,稀释时应先将_____(填“浓硫酸”或“水”)倒入容器中。 (2)该样品中含碱式碳酸铜的质量是多少? (3)通过计算,判断样品中含碱式碳酸铜的质量分数是否达到要求? |
参考解答
| (1)水 (2)解:样品中含碱式碳酸铜的质量为x。 方法一:Cu2(OH)2CO3+2H2SO4==2CuSO4+3H2O+CO2↑ 222 44 x 4.4g 222:44=x:4.4g 解得x=22.2g 答:样品中含碱式碳酸铜的质量为22.2g。 方法二:Cu2(OH)2CO3+2H2SO4==2CuSO4+3H2O+CO2↑ 222 196 x 98g×20% 222:196=x:(98g×20%) 解得x=22.2g 答:样品中含碱式碳酸铜的质量为22.2g。 (3) 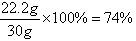 74%大于70% 答:样品中碱式碳酸铜的含量达到要求。 |
相似问题
某中学课外活动小组在实验室模拟我国化工专家侯德榜先生发明的“联合制碱法”(即“侯氏制碱法”) 其原理
某中学课外活动小组在实验室模拟我国化工专家侯德榜先生发明的“联合制碱法”(即“侯氏制碱法”),其原理是向氨化的饱和氯化钠溶液通入足量的二氧化碳
同学们从山上采集到一种石灰石 他们取80克该样品进行煅烧实验(所含杂质在煅烧过程中不发生变化) 测得
同学们从山上采集到一种石灰石,他们取80克该样品进行煅烧实验(所含杂质在煅烧过程中不发生变化),测得反应后固体的质量(m)与反应时间(t)的关系如下表:
某校化学兴趣小组同学发现 长期使用的热水壶底部有一层水垢 水垢的主要成分是碳酸钙和氢氧化镁。他们为了
某校化学兴趣小组同学发现,长期使用的热水壶底部有一层水垢,水垢的主要成分是碳酸钙和氢氧化镁。他们为了测定水垢中碳酸钙的含量,将足量质量分数为10
向50.0g8.0%的氢氧化钠溶液中加入一定量的稀硫酸恰好完全反应。(1)求反应前氢氧化钠溶液中溶质
向50 0g8 0%的氢氧化钠溶液中加入一定量的稀硫酸恰好完全反应。(1)求反应前氢氧化钠溶液中溶质的质量。(2)求反应后生成硫酸钠的质量。
Fe Mg Al三种金属分别跟稀盐酸充分反应 得到相同质量的氢气 其原因是[ ]A.Fe M
Fe、Mg、Al三种金属分别跟稀盐酸充分反应,得到相同质量的氢气,其原因是[ ]A Fe、Mg、Al的质量相等,盐酸足量 B Fe、Mg、Al的质量比是28∶12∶9,盐酸












