在活动与探究实验中 老师提供了一包钾肥(包装上注明主要原因成份是硫酸钾 化学式为K2SO4 纯度为9
| 在活动与探究实验中,老师提供了一包钾肥(包装上注明主要原因成份是硫酸钾,化学式为K2SO4,纯度为95.0%)样品给同学们,让同学们通过实验确定该样品的纯度(硫酸钾的质量分数)是否符合标准。丽丽同学称取8.0克样品,加入适量的水溶解后,与足量的BaCl2溶液充分反应,生成BaSO4沉淀,过滤、洗涤、烘干沉淀,测得其质量为9.8克,试通过计算确定该化肥的纯度是否符合包装袋上的说明(假设杂质不与BaCl2溶液反应,计算结果精确到0.1%)。 |
参考解答
| 解:设8.0克样品中所含K2SO4的质量为x。 K2SO4+BaCl2==BaSO4↓+2KCl 174 233 x 9.8克 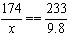 x=7.32(克) 样品中所含K2SO4的质量分数为:K2SO4%= 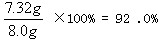 因为:92.0%小于95.0%,该化肥的纯度不符合包装袋上的说明。 |
相似问题
学校化学兴趣小组为测定我市一特铸厂原料生铁中铁的质量分数 在实验室将8.7g生铁样品放入烧杯中 加入
学校化学兴趣小组为测定我市一特铸厂原料生铁中铁的质量分数,在实验室将8 7g生铁样品放入烧杯中,加入50g稀硫酸恰好完全反应(杂质不参加反应),反应后称
(A组选做题)将4.4gCO2通入200g4%的NaOH溶液中 恰好完全反应。 (1)反应后所得溶液
(A组选做题)将4 4gCO2通入200g4%的NaOH溶液中,恰好完全反应。 (1)反应后所得溶液的质量为______________g。 (2)求生成的Na2CO3的质量 (3)反应
潍纺市具有丰富的石灰石矿产资源。有一矿山上的石灰石样品只含二氧化硅杂质(二氧化硅既不溶于水 也不与盐
潍纺市具有丰富的石灰石矿产资源。有一矿山上的石灰石样品只含二氧化硅杂质(二氧化硅既不溶于水,也不与盐酸反应)。某化学课外活动小组为测定石灰石样品
现有1g某种钾肥样品 其成分为碳酸钾 硫酸钾及少量不含钾元素的难溶性杂质。为测定该钾肥样品中钾元素的
现有1g某种钾肥样品,其成分为碳酸钾、硫酸钾及少量不含钾元素的难溶性杂质。为测定该钾肥样品中钾元素的质量分数,过程如下:[反应原理]K2CO3+H2SO4==K2
某校化学兴趣小组为测定空气中二氧化硫的含量 用NaOH溶液吸收SO2 反应化学方程式如下:2NaOH
某校化学兴趣小组为测定空气中二氧化硫的含量,用NaOH溶液吸收SO2,反应化学方程式如下:2NaOH+SO2=Na2SO3+H2O 若用20g NaOH溶液吸收1000L已除去CO2












