参考解答
正确答案:金属性是金属原子的性质是指元素的原子是否容易失去电子或得到电子。金属性强的元素容易失去电子非金属性强的元素容易得到电子。失去电子的能力大小用电离能来表示;得到电子的能力大小用电子亲合能来表示;综合考虑原子得失电子的能力用电负性表示。电负性是原子形成负离子倾向的能力。电负性小失去电子能力大形成负离子倾向小金属性强;反之非金属性强。电负性的大小与原子的核电荷、原子半径、电子层排布、最外电子层的电子数有关。正因为核外电子排布的周期性所以金属性与非金属性呈周期性变化。而金属活动性是指金属单质在水溶液中形成水合离子倾向的能力。金属单质的性质除与金属原子的电子结构有关外还与分子结构、晶体结构有关。金属单质不是金属原子的简单堆积金属原子间存在着金属键金属键的强弱用升华热表示。电极电势是金属在水溶液中形成阳离子趋势大小的标志是升华热、电离能、水合热的综合结果。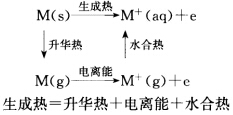 金属活动顺序表基本上按金属在水溶液中形成低价离子的标准电极电势顺序排列:
金属活动顺序表基本上按金属在水溶液中形成低价离子的标准电极电势顺序排列: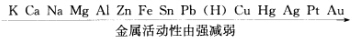 金属活动顺序表中Ca、Na的顺序与以前的金属活动顺序表中的顺序是相反的。从Ca、Na与水的反应放出氢气的快慢能否说明Na比Ca活泼呢?当然不能。Ca的标准电极电势比Na稍负些即Ca比Na生成水合离子的趋势大一些主要原因是钙的水合热约为钠的4倍(Na+半径97pm水合热-397kJ.mol ;Ca2+半径99pm水合热-1653kJ.mol-1)。 按标准电极电势从小到大排列是从热力学角度指出氧化还原的可能性与趋势大小当然不能依其反应的快慢(动力学)来说明。此外标准电极电势是受条件限制的所以金属活动顺序是有条件的、相对的。例如氢气在一个大气压下氢离子浓度为1mol.L-1时氢分子可以从1mol.-1铜离子溶液中置换出金属铜但在加热条件下铜却可以从浓盐酸中置换出氢气。 “一般说来可从元素的单质与水或酸起反应置换氢的难易或从元素的氧化物的水化物——氢氧化物的碱性强弱来判断元素金属性的强弱;从元素氧化物的水化物的酸性强弱或从与氢气生成气态氢化物的难易来判断元素非金属性的强弱”。显然这种说法将金属性强弱与金属活动顺序混为一谈也就是说将金属元素的性质与单质的性质混为一谈。 以铜与锌为例它们的I1I2及升华热数据如下
金属活动顺序表中Ca、Na的顺序与以前的金属活动顺序表中的顺序是相反的。从Ca、Na与水的反应放出氢气的快慢能否说明Na比Ca活泼呢?当然不能。Ca的标准电极电势比Na稍负些即Ca比Na生成水合离子的趋势大一些主要原因是钙的水合热约为钠的4倍(Na+半径97pm水合热-397kJ.mol ;Ca2+半径99pm水合热-1653kJ.mol-1)。 按标准电极电势从小到大排列是从热力学角度指出氧化还原的可能性与趋势大小当然不能依其反应的快慢(动力学)来说明。此外标准电极电势是受条件限制的所以金属活动顺序是有条件的、相对的。例如氢气在一个大气压下氢离子浓度为1mol.L-1时氢分子可以从1mol.-1铜离子溶液中置换出金属铜但在加热条件下铜却可以从浓盐酸中置换出氢气。 “一般说来可从元素的单质与水或酸起反应置换氢的难易或从元素的氧化物的水化物——氢氧化物的碱性强弱来判断元素金属性的强弱;从元素氧化物的水化物的酸性强弱或从与氢气生成气态氢化物的难易来判断元素非金属性的强弱”。显然这种说法将金属性强弱与金属活动顺序混为一谈也就是说将金属元素的性质与单质的性质混为一谈。 以铜与锌为例它们的I1I2及升华热数据如下 从所列数据可知它们失去两个电子的能量差别很小但单质锌在很多化学反应中比单质铜要活泼得多原因就是Zn的升华热比Cu的升华热小得多。再以锂、钠与钾为例:
从所列数据可知它们失去两个电子的能量差别很小但单质锌在很多化学反应中比单质铜要活泼得多原因就是Zn的升华热比Cu的升华热小得多。再以锂、钠与钾为例: 从以上数据可知锂的标准电极电势最负表示金属锂最容易失去电子转变为水合锂离子所以锂的活动性比钾大(这是指热力学上)。至于锂与水反应不如钠激烈是因为锂熔点高反应时产生的热不能使它熔化反应物LiOH溶解度小覆盖在表面阻碍反应进行(反应速度是动力学问题)。从锂的电离能看比本族元素都大即外层电子不易失去钾易失去电子金属性应是钾比锂强但金属活动性锂比钾大得多。 又如从周期表上看铅(第六周期)与锡(第五周期)是同一族铅的金属性强但锡的活动性却在铅的前面。
从以上数据可知锂的标准电极电势最负表示金属锂最容易失去电子转变为水合锂离子所以锂的活动性比钾大(这是指热力学上)。至于锂与水反应不如钠激烈是因为锂熔点高反应时产生的热不能使它熔化反应物LiOH溶解度小覆盖在表面阻碍反应进行(反应速度是动力学问题)。从锂的电离能看比本族元素都大即外层电子不易失去钾易失去电子金属性应是钾比锂强但金属活动性锂比钾大得多。 又如从周期表上看铅(第六周期)与锡(第五周期)是同一族铅的金属性强但锡的活动性却在铅的前面。
金属性是金属原子的性质,是指元素的原子是否容易失去电子或得到电子。金属性强的元素容易失去电子,非金属性强的元素容易得到电子。失去电子的能力大小,用电离能来表示;得到电子的能力大小,用电子亲合能来表示;综合考虑原子得失电子的能力,用电负性表示。电负性是原子形成负离子倾向的能力。电负性小,失去电子能力大,形成负离子倾向小,金属性强;反之,非金属性强。电负性的大小与原子的核电荷、原子半径、电子层排布、最外电子层的电子数有关。正因为核外电子排布的周期性,所以金属性与非金属性呈周期性变化。而金属活动性是指金属单质在水溶液中形成水合离子倾向的能力。金属单质的性质除与金属原子的电子结构有关外,还与分子结构、晶体结构有关。金属单质不是金属原子的简单堆积,金属原子间存在着金属键,金属键的强弱用升华热表示。电极电势是金属在水溶液中形成阳离子趋势大小的标志,是升华热、电离能、水合热的综合结果。金属活动顺序表基本上按金属在水溶液中形成低价离子的标准电极电势顺序排列:金属活动顺序表中Ca、Na的顺序与以前的金属活动顺序表中的顺序是相反的。从Ca、Na与水的反应放出氢气的快慢能否说明Na比Ca活泼呢?当然不能。Ca的标准电极电势比,Na稍负些,即Ca比Na生成水合离子的趋势大一些,主要原因是钙的水合热约为钠的4倍(Na+半径97pm,水合热-397kJ.mol;Ca2+半径99pm,水合热-1653kJ.mol-1)。按标准电极电势从小到大排列,是从热力学角度指出氧化还原的可能性与趋势大小,当然不能依其反应的快慢(动力学)来说明。此外,标准电极电势是受条件限制的,所以金属活动顺序是有条件的、相对的。例如,氢气在一个大气压下,氢离子浓度为1mol.L-1时,氢分子可以从1mol.-1铜离子溶液中置换出金属铜,但在加热条件下,铜却可以从浓盐酸中置换出氢气。“一般说来,可从元素的单质与水或酸起反应置换氢的难易,或从元素的氧化物的水化物——氢氧化物的碱性强弱来判断元素金属性的强弱;从元素氧化物的水化物的酸性强弱,或从与氢气生成气态氢化物的难易来判断元素非金属性的强弱”。显然,这种说法将金属性强弱与金属活动顺序混为一谈,也就是说,将金属元素的性质与单质的性质混为一谈。以铜与锌为例,它们的I1I2及升华热数据如下从所列数据可知,它们失去两个电子的能量差别很小,但单质锌在很多化学反应中比单质铜要活泼得多,原因就是Zn的升华热比Cu的升华热小得多。再以锂、钠与钾为例:从以上数据可知,锂的标准电极电势最负,表示金属锂最容易失去电子转变为水合锂离子,所以锂的活动性比钾大(这是指热力学上)。至于锂与水反应不如钠激烈,是因为锂熔点高,反应时产生的热不能使它熔化,反应物LiOH溶解度小,覆盖在表面阻碍反应进行(反应速度是动力学问题)。从锂的电离能看,比本族元素都大,即外层电子不易失去,钾易失去电子,金属性应是钾比锂强,但金属活动性锂比钾大得多。又如,从周期表上看,铅(第六周期)与锡(第五周期)是同一族,铅的金属性强,但锡的活动性却在铅的前面。
相似问题
计算具有105eV能量的光子的波长。请帮忙给出正确答案和分析 谢谢!
计算具有105eV能量的光子的波长。请帮忙给出正确答案和分析,谢谢!
某物流公司由三个仓库 每天向四个超市供应某种货物。已知三个仓库A1 A2 A3此种货物储藏量分别为7
某物流公司由三个仓库,每天向四个超市供应某种货物。已知三个仓库A1,A2,A3此种货物储藏量分别为7箱、4箱和9箱。该物流公司把这些货物分别送到B1,B2,
某车间有5项加工任务。必须先经过设备A加工之后 才能进入设备B加工 每项任务在每台设备上所需时间见表
某车间有5项加工任务。必须先经过设备A加工之后,才能进入设备B加工,每项任务在每台设备上所需时间见表3.11所示。问如何安排这5项任务的加工顺序可使加
钠原子的基态是3s1 激发态为ns1(n≥4) np1(n≥3)或nd1(n≥4) 钠原子能产生下列
钠原子的基态是3s1,激发态为ns1(n≥4)、np1(n≥3)或nd1(n≥4),钠原子能产生下列哪条谱线? ①2D1 2→2S1 2; ②3P2→3D2; ③2F7 2→2D5 2; ④1P→
一个公司要分派4个推销员去4个地区推销某种商品 4个推销员各有不同的经验和能力 因而他们在每一地区能
一个公司要分派4个推销员去4个地区推销某种商品,4个推销员各有不同的经验和能力,因而他们在每一地区能获得的利润不同,其估计值如表6.12所示。 请帮












