现有如下仪器 仪器中已注入溶液 回答下列问题。(1)加热装置A 写出铜与浓硫酸反应的化学方程式:
现有如下仪器,仪器中已注入溶液,回答下列问题。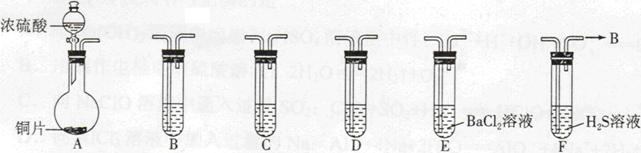 (1)加热装置A,写出铜与浓硫酸反应的化学方程式: ,烧瓶中的实验现象为 。 (2)验证碳、硅非金属性的相对强弱(已知酸性:H2SO3>H2CO3),若选择仪器A、B、C、D并相连接,则B、C、D中所选择的试剂分别为 、 、 。能说明碳的非金属性比硅强的实验现象是 。 (3)验证SO2的氧化性、还原性。若选择A、E、F仪器,并按A、E、F顺序连接。 ①则证明SO2有氧化性的实验现象是 ,反应方程式为: 。 ②若证明SO2具有还原性,在E中采取的实验操作为 ,其实验现象为 ,反应原理为 。 |
参考解答
(1)Cu+2H2SO4(浓)  CuSO4+SO2↑+2H2O; 1分 CuSO4+SO2↑+2H2O; 1分铜片变灰黑色表面有气泡生成,烧瓶中可能有白色物质生成 2分 (2)B:Na2CO3溶液或 NaHCO3 溶液 C:KMnO4溶液 D:Na2SiO3溶液 ; C中KMnO4溶液不褪色(或品红不褪色),D中出现白色沉淀。 各1分,共4分 (3)①H2S溶液中有浅黄色混浊出现 2H2S+SO2=3S↓+2H2O 各1分共2分 ②通入氯气或加入氯水或加入过氧化氢溶液,或高锰酸钾溶液等氧化剂(其中一种或其它合理答案均可);现象是有白色沉定生成。 各1分共2分 根据所加入试剂写出方程式 Ba2++SO2+Cl2+2H2O=BaSO4↓+4H++2Cl? 2分 |
试题分析:(1)铜与浓硫酸反应的化学方程式Cu+2H2SO4(浓)  CuSO4+SO2↑+2H2O;烧瓶中的实验现象为铜片变灰黑色表面有气泡生成,烧瓶中可能有白色物质生成 CuSO4+SO2↑+2H2O;烧瓶中的实验现象为铜片变灰黑色表面有气泡生成,烧瓶中可能有白色物质生成(2)因为酸性:H2SO3>H2CO3> H2SiO3,若选择仪器A、B、C、D,A中产生二氧化硫气体,需和碳酸盐反应产生二氧化碳气体,在通入硅酸钠溶液之前应把二氧化硫除去以免给实验带来干扰。所以B、C、D依次放Na2CO3溶液或 NaHCO3 溶液、KMnO4溶液(或品红溶液)、Na2SiO3溶液,能说明碳的非金属性比硅强的实验现象是C中KMnO4溶液不褪色(或品红不褪色),D中出现白色沉淀。 (3) ①则证明SO2有氧化性的实验是将二氧化硫气体通入硫化氢溶液中,有淡黄色浑浊产生,对应的化学方程式为2H2S+SO2=3S↓+2H2O,在该反应中二氧化硫作氧化剂,显示氧化性, ②若将二氧化硫直接通入氯化钡溶液中无现象,需将二氧化硫进一步氧化,氧化剂可选氯气、氯水、过氧化氢溶液、高锰酸钾溶液、铁盐溶液等,对应的现象是有白色沉淀产生,反应原理是:根据所加入试剂写出离子方程式 Ba2++SO2+Cl2+2H2O=BaSO4↓+4H++2Cl? |
相似问题
在含有NaCl NaBr NaI混合溶液中滴加足量的溴水 经充分反应后 将溶液蒸干并灼烧 残渣固体为
在含有NaCl、NaBr、NaI混合溶液中滴加足量的溴水,经充分反应后,将溶液蒸干并灼烧,残渣固体为[ ]A、NaCl、I2 B、NaBr、NaCl和Br2C、NaBr、NaCl和I2D、NaCl、NaBr
氯气是一种化学性质很活泼的非金属单质 它具有较强的氧化性 下列叙述中不正确的是[ ]A.红热
氯气是一种化学性质很活泼的非金属单质,它具有较强的氧化性,下列叙述中不正确的是[ ]A.红热的铜丝在氯气里剧烈燃烧,生成棕黄色的烟 B.钠在氯气中
(22分)黄铁矿(FeS2)燃烧产生的SO2通过下列工艺过程既能制得H2SO4 又能制得H2。(1)
(22分)黄铁矿(FeS2)燃烧产生的SO2通过下列工艺过程既能制得H2SO4,又能制得H2。(1)该过程中能循环利用的物质为。(2)写出反应器中发生反应的离子方程
新制氯水中含有多种成分 因而具有多种性质 下图所示新制氯水分别与四种物质发生反应 其中能证明新制氯水
新制氯水中含有多种成分,因而具有多种性质,下图所示新制氯水分别与四种物质发生反应,其中能证明新制氯水具有酸性的是 [ ]A.a B.b C.c D.d
海水中主要含有Na+ K+ Mg2+ Ca2+ Cl- Br- SO42- HCO3- CO32-等
海水中主要含有Na+、K+、Mg2+、Ca2+、Cl-、Br-、SO42-、HCO3-、CO32-等离子,火力发电时排放的烟气可用海水脱硫,其工艺流程如下图所示,下列说法错误












