(22分)黄铁矿(FeS2)燃烧产生的SO2通过下列工艺过程既能制得H2SO4 又能制得H2。(1)
(22分)黄铁矿(FeS2)燃烧产生的SO2通过下列工艺过程既能制得H2SO4,又能制得H2。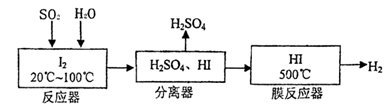 (1)该过程中能循环利用的物质为 。 (2)写出反应器中发生反应的离子方程式 。 (3)某研究性学习小组欲探究SO2能否与BaCl2溶液反应生成BaSO3沉淀,进行如下实验。 已知浓硫酸的沸点为338oC,加热时酒精灯火焰的温度为400oC~500oC。 ①甲同学用装置I(如下图)进行实验,发现BaCl2溶液中出现白色沉淀,且白色沉淀不溶于盐酸,该实验结论不能说明SO2能与BaCl2溶液发生反应,请解释生成该白色沉淀的两种可能原因(用文字和离子方程式表示): , ; ②乙同学设计了装置Ⅱ(夹持装置和A的加热装置略去)进行实验,发现C中没有出现白色沉淀。 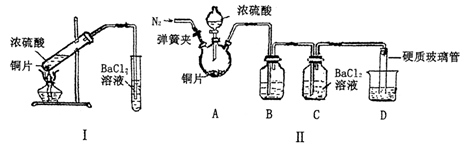 装置Ⅱ改进了装置I的四处不足,请填表说明另外的三处。
a.NaOH溶液 b.H2O2溶液 C.新制氯水 d.酸性KMnO4溶液 |
参考解答
| (1)I2;(2)I2 + SO2 + 2H2O====2I- + SO42- + 4H+;(3)①挥发出的硫酸与氯化钡反应生成BaSO4沉淀,SO42-+Ba2+═BaSO4↓,二氧化硫和氧气在水溶液反应生成硫酸,硫酸和氯化钡反应生成硫酸钡沉淀,2Ba2++2SO2+O2+2H2O═2BaSO4↓+4H+;②实验前向A中通入N2,排出装置中的O2;A、C之间添加装有饱和亚硫酸氢钠溶液的洗气瓶,除去挥发出的H2SO4蒸汽;将导管末端连接硬质玻璃管,二氧化硫通入氢氧化钠溶液中,吸收多余的尾气并防止倒吸。(4)b。 |
试题分析:由题给工艺流程知,反应器内发生的反应为I2 + SO2 + 2H2O====2I- + SO42- + 4H+,分离器分离出硫酸,膜反应器中发生的反应为2HI 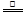 I2 + H2。(1)由上述分析可知能循环利用的物质为I2;(2)反应器发生反应的离子方程式为I2 + SO2 + 2H2O====2I- + SO42- + 4H+;(3)①由题给信息知,“浓硫酸的沸点为338℃,加热时酒精灯火焰的温度为400℃~500℃”,说明浓硫酸在温度较高时也能挥发出H2SO4蒸气。由于BaSO3能够溶于盐酸,该沉淀只能是BaSO4,有可能是挥发出的H2SO4提供的SO42-与Ba2+反应生成BaSO4:SO42-+Ba2+═BaSO4↓,也有可能是溶液中溶解的氧气与SO2作用产生了硫酸,进而得到BaSO4:2Ba2++2SO2+O2+2H2O═2BaSO4↓+4H+;②对比装置Ⅰ 、Ⅱ可知,装置Ⅱ使用分液漏斗滴加浓硫酸,利于控制反应速率;实验前A中通入N2目的是排出装置中的O2;C中没有出现白色沉淀,说明B中的试剂能吸收挥发出的H2SO4且不产生新的杂质,该试剂应是饱和NaHSO3溶液;将导管末端连接硬质玻璃管,二氧化硫通入氢氧化钠溶液中,作用是吸收多余的二氧化硫,防止倒吸。(4)乙实验后的C中的溶液会溶有SO2,不溶于盐酸的白色沉淀应是BaSO4,故滴加一种无色溶液,发生了氧化还原反应,只能是H2O2溶液,因新制氯水是黄绿色,酸性KMnO4溶液是紫色;选:b。 I2 + H2。(1)由上述分析可知能循环利用的物质为I2;(2)反应器发生反应的离子方程式为I2 + SO2 + 2H2O====2I- + SO42- + 4H+;(3)①由题给信息知,“浓硫酸的沸点为338℃,加热时酒精灯火焰的温度为400℃~500℃”,说明浓硫酸在温度较高时也能挥发出H2SO4蒸气。由于BaSO3能够溶于盐酸,该沉淀只能是BaSO4,有可能是挥发出的H2SO4提供的SO42-与Ba2+反应生成BaSO4:SO42-+Ba2+═BaSO4↓,也有可能是溶液中溶解的氧气与SO2作用产生了硫酸,进而得到BaSO4:2Ba2++2SO2+O2+2H2O═2BaSO4↓+4H+;②对比装置Ⅰ 、Ⅱ可知,装置Ⅱ使用分液漏斗滴加浓硫酸,利于控制反应速率;实验前A中通入N2目的是排出装置中的O2;C中没有出现白色沉淀,说明B中的试剂能吸收挥发出的H2SO4且不产生新的杂质,该试剂应是饱和NaHSO3溶液;将导管末端连接硬质玻璃管,二氧化硫通入氢氧化钠溶液中,作用是吸收多余的二氧化硫,防止倒吸。(4)乙实验后的C中的溶液会溶有SO2,不溶于盐酸的白色沉淀应是BaSO4,故滴加一种无色溶液,发生了氧化还原反应,只能是H2O2溶液,因新制氯水是黄绿色,酸性KMnO4溶液是紫色;选:b。 |
相似问题
新制氯水中含有多种成分 因而具有多种性质 下图所示新制氯水分别与四种物质发生反应 其中能证明新制氯水
新制氯水中含有多种成分,因而具有多种性质,下图所示新制氯水分别与四种物质发生反应,其中能证明新制氯水具有酸性的是 [ ]A.a B.b C.c D.d
海水中主要含有Na+ K+ Mg2+ Ca2+ Cl- Br- SO42- HCO3- CO32-等
海水中主要含有Na+、K+、Mg2+、Ca2+、Cl-、Br-、SO42-、HCO3-、CO32-等离子,火力发电时排放的烟气可用海水脱硫,其工艺流程如下图所示,下列说法错误
下列关于氯水的叙述 正确的是[ ]A.新制氯水中只含Cl2和H2O分子B.新制氯水可使蓝色石
下列关于氯水的叙述,正确的是[ ]A.新制氯水中只含Cl2和H2O分子B.新制氯水可使蓝色石蕊试纸先变红后褪色C.光照氯水有气泡选出,该气体是Cl2 D.氯水
将甲气体通入BaCl2溶液 未见沉淀生成 然后通入乙气体 有沉淀生成 则甲 乙气体不可能是A.SO2
将甲气体通入BaCl2溶液,未见沉淀生成,然后通入乙气体,有沉淀生成,则甲、乙气体不可能是A.SO2、H2SB.SO2、NO2 C.NH3、CO2 D.CO2、SO2
向5 mL 18 mol/L的硫酸中加入足量铜片并加热使其充分反应 下列说法正确的是( )A.有0
向5 mL 18 mol L的硫酸中加入足量铜片并加热使其充分反应,下列说法正确的是()A.有0 09 mol的硫酸被还原B.有0 045 mol的硫酸被还原C.充分反应












