现用如图1所示的装置制取较多量的饱和氯水并测定饱和氯水的pH.回答有关问题:(1)写出有关化学方程式
现用如图1所示的装置制取较多量的饱和氯水并测定饱和氯水的pH.回答有关问题: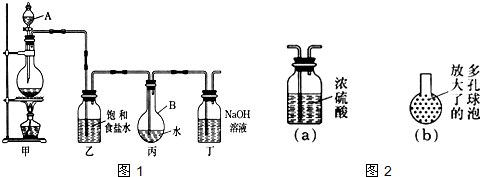 (1)写出有关化学方程式. 装置甲:______; 装置丁:______. (2)证明氯水已饱和的现象是______. (3)制取结束时,装置丙的液体中含有最多的微粒是______(水分子除外);装置乙的作用是______. (4)有如下改进措施或建议,请作出评价: ①在装置乙和丙之间增加如图2(a)所示的装置,你认为有无必要?______. ②在装置丙的长导管下口处,接如图2(b)所示的多孔球泡,这样做的好处是:______. ③若撤去装置乙,直接将装置甲和丙相连.这样做对实验结果的影响是:______. |
参考解答
(1)实验室制取氯气的反应原理:MnO2+4HCl(浓)
故答案为:MnO2+4HCl(浓)
(2)因饱和溶液中不能溶解氯气以及氯气为黄绿色,所以丙中的导管有气泡溢出水面,且液面上方充满黄绿色气体即可证明氯水已饱和, 故答案为:丙中的导管有气泡溢出水面,且液面上方充满黄绿色气体; (3)由氯水中成分可知,氯水中含有最多的微粒除了水就是氯气;饱和食盐水来除去氯气中的氯化氢; 故答案为:Cl2;除去氯气中的氯化氢; (4)①因氯气中含水对制备氯水无影响,所以在装置乙和丙之间不需要增加如图2(a)所示的装置;故答案为:无; ②因多孔球泡的表面积大,能加快氯气溶解的速率,故答案为:增加氯气与水的接触面积,利于氯气溶解; ③因氯气中含有氯化氢,氯化氢溶于水,溶液酸性增强,使测定的pH减小, 故答案为:使测定的pH减小; |
相似问题
50 g含有1.17 g氯化钠和0.84 g氟化钠的溶液中加入过量的硝酸银溶液 充分反应后搅拌 静置
50 g含有1 17 g氯化钠和0 84 g氟化钠的溶液中加入过量的硝酸银溶液,充分反应后搅拌、静置、过滤、洗涤、干燥得到2 87 g固体,由此可得出的结论是(
氯气有毒 一旦泄露会造成对空气的严重污染。工业上常用浓氨水检验氯气管是否漏气。(已知Cl2可将NH3
氯气有毒,一旦泄露会造成对空气的严重污染。工业上常用浓氨水检验氯气管是否漏气。(已知Cl2可将NH3氧化成N2)请简要说明这种检验方法的依据:。并写出
向NaBr与NaI的混合溶液中通入适量Cl2 反应完全后将溶液蒸干并小心灼烧至恒重 得固体W。(1)
向NaBr与NaI的混合溶液中通入适量Cl2,反应完全后将溶液蒸干并小心灼烧至恒重,得固体W。(1)W的可能组成为①____________;②________;③____________;④_
下列叙述中正确的是……( ) A.氯水 亚硫酸 活性炭的漂白或脱色原理虽然不同 但它们都能使品红或墨
下列叙述中正确的是……( ) A.氯水、亚硫酸、活性炭的漂白或脱色原理虽然不同,但它们都能使品红或墨迹褪色; B.将等物质的量的Cl2和SO2同时与潮
漂白粉和泡腾片用于环境消毒和饮用水消毒 已知泡腾片消毒原理如下图:下列有关说法不正确的是A.漂白粉需
漂白粉和泡腾片用于环境消毒和饮用水消毒,已知泡腾片消毒原理如下图:下列有关说法不正确的是A.漂白粉需密闭储存B.工业上制取漂白粉可将氯气通入石灰












