在200mL含Mg2+ Al3+ NH4+ H+ Cl-等离子的溶液中 逐滴加入5mol?L-1的氢
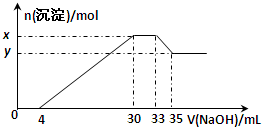
在200mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入5mol?L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mol)关系如下图所示.下列叙述正确的是( )
 |
参考解答
| A、由图象可知,x与y的差值即为Al(OH)3的物质的量,由Al(OH)3+NaOH=NaAlO2+2H2O,NaOH的物质的量为(35-33)mL×10-3L×5mol?L-1=0.01mol,即Al(OH)3的物质的量也为 0.01mol,故A错误; B、溶液中的阴离子只有Cl-,则加入35mLNaOH溶液时Cl-全部存在于NaCl中,则Cl-的物质的量为35mL×10-3L×5mol?L-1=0.175mol,原溶液中c(Cl-)=
C、0~4mL发生H+与氢氧化钠的反应,则H+的物质的量为4mL×10-3L×5mol?L-1=0.02mol,c(H+)=
D、由Al3+~Al(OH)3,则n(Al3+)=0.01mol,4~30mL发生Mg2+、Al3+与氢氧化钠的反应生成沉淀,共消耗NaOH的物质的量为(30-4)mL×10-3L×5mol?L-1=0.13mol,Al3+消耗的NaOH的物质的量为0.01mol×3=0.03mol,则与Mg2+反应的NaOH的物质的量为0.13mol-0.03mol=0.1mol,由Mg2++2OH-═Mg(OH)2↓,n(Mg2+)=0.05mol,原溶液中n(Mg2+):n(Al3+)=5:1,故D错误; 故选C. |
相似问题
下列离子方程式正确的是( )A.过氧化钠和水反应:2Na2O2+2H2O═4Na++4OH-+O2
下列离子方程式正确的是( )A.过氧化钠和水反应:2Na2O2+2H2O═4Na++4OH-+O2↑B.用铜为电极电解饱和食盐水:2Cl-+2H2O通电 Cl2↑+H2↑+2OH-C.在明
把含硫酸铵和硝酸铵的混合液a L分成两等份.一份加入含b mol NaOH的溶液并加热 恰好把NH3
把含硫酸铵和硝酸铵的混合液aL分成两等份.一份加入含bmolNaOH的溶液并加热,恰好把NH3全部赶出;另一份需消耗cmolBaCl2才能使SO42-完全沉淀,则原溶液中
下列离子方程式正确的是( )A.0.01mol/L NH4Al(SO4)2溶液与0.02 mol/
下列离子方程式正确的是( )A.0 01mol LNH4Al(SO4)2溶液与0 02mol LBa(OH)2溶液等体积混合产生沉淀:NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al
下列化学方程式改写成离子方程式正确的是( )A.2NaOH+Cl2=NaCl+NaClO+H2O;
下列化学方程式改写成离子方程式正确的是( )A.2NaOH+Cl2=NaCl+NaClO+H2O;Cl2+2OH-=Cl-+ClO-+H2OB.CaCO3+2HCl=CaCl2+CO2↑+H2O;CO32-+2H+=CO2↑+
下列离子方程式正确的是( )A.NaHSO3溶液中投入过氧化钠粉末:4HSO3-+2Na2O2=4
下列离子方程式正确的是( )A.NaHSO3溶液中投入过氧化钠粉末:4HSO3-+2Na2O2=4SO32-+O2↑+4Na+B.惰性电极电解氯化钠溶液:2Cl-+2H2O电解 Cl2↑+H2












