往20mL硫酸和盐酸的混合溶液中 加入0.05mol/LBa(OH)2溶液时 生成BaSO4的量和溶
| 往20mL硫酸和盐酸的混合溶液中,加入0.05mol/LBa(OH)2溶液时,生成BaSO4的量和溶液的pH变化如图.试回答: (1)起始时,混酸中H2SO4的物质的量浓度为多少? (2)起始时,混酸中盐酸的物质的量浓度为多少? (3)B点时溶液的pH是多少? 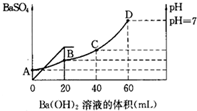 |
参考解答
| 由图可知,0~20mLBa(OH)2溶液发生H2SO4+Ba(OH)2═BaSO4↓+H2O,20mL~60mLBa(OH)2溶液发生发生H++OH-═H2O, (1)设硫酸的物质的量为x,则 H2SO4+Ba(OH)2═BaSO4↓+H2O 1 1 x 0.02L×0.05mol?L-1
硫酸的物质的量浓度为
答:起始时,混酸中H2SO4的物质的量浓度为0.05mol/L; (2)设HCl的物质的量为y,则 H++OH-═H2O 1 1 y 0.04L×2×0.05mol/L y=0.002mol,则盐酸的浓度为
答:起始时,混酸中盐酸的物质的量浓度为0.2mol/L; (3)由图可知,B点硫酸完全反应,氢离子的浓度为
答:B点时溶液的pH是1. |
相似问题
下列是某同学对相应反应的离子方程式所作的评价 其中对应的评价合理的是( )编号化学反应离子方程式评
下列是某同学对相应反应的离子方程式所作的评价,其中对应的评价合理的是( )编号化学反应离子方程式评价A把MgSO4溶液滴入Ba(OH)2溶液Mg2++2OH-═M
下列离子方程式书写不正确的是( )A.NaOH溶液与SO2反应 当n(NaOH):n(SO2)=4
下列离子方程式书写不正确的是( )A.NaOH溶液与SO2反应,当n(NaOH):n(SO2)=4:3时:4OH-+3SO2=SO32-+2HSO3-+H2OB.酸性条件下KIO3溶液与KI溶液
下列离子方程式书写正确的是( )A.向澄清石灰水中加入过量的碳酸氢钠溶液:Ca2++OH-+HCO
下列离子方程式书写正确的是( )A.向澄清石灰水中加入过量的碳酸氢钠溶液:Ca2++OH-+HCO3-═CaCO3↓+H2OB.铜片溶于三氯化铁溶液:Fe3++Cu═Fe2++Cu
下列表达中 正确的是( )A.饱和氯水中可大量共存Na+ CO32- SO32-B.溶液中可大量共
下列表达中,正确的是( )A.饱和氯水中可大量共存Na+、CO32-、SO32-B.溶液中可大量共存Mg2+、HCO3-、SO42-、OH-C.向稀硝酸中加入过量的铁粉:3Fe+
将0.65g锌加到50mL1mol?L的盐酸中 (1)写出发生反应的离子方程式______.(2)计
将0 65g锌加到50mL1mol?L的盐酸中,(1)写出发生反应的离子方程式______.(2)计算生成H2的体积______.(标准状况下)(3)若反应结束后,溶液的体积












