某厂的酸性工业废水中含有一定量的Na+ Al3+ Fe3+ Cu2+ Cl-。该厂利用如图所示的工艺
某厂的酸性工业废水中含有一定量的Na+、Al3+、Fe3+、Cu2+、Cl-。该厂利用如图所示的工艺流程图,利用常见的气体氧化物、酸、碱和工业生产中的废铁屑,从废水中生产出了氯化铁、氧化铝、NaCl晶体和金属铜,产生了很好的社会经济效益。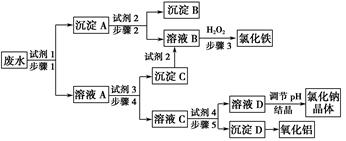 请填写下列空白: (1)图中试剂1是________,试剂2是________。 (2)步骤1和步骤2所用到的玻璃仪器是________。 (3)步骤1反应的离子方程式为__________________________________。 (4)步骤3反应的离子方程式为__________________________________。 (5)从节约药品和环保方面考虑,步骤5所发生反应的离子方程式应为____________________________。 |
参考解答
| (1)废铁屑 稀盐酸 (2)漏斗、玻璃棒、烧杯 (3)Fe+Cu2+=Cu+Fe2+,Fe+2Fe3+=3Fe2+,Fe+2H+=Fe2++H2↑ (4)2Fe2++H2O2+2H+=2Fe3++2H2O (5)AlO2+2H2O+CO2=Al(OH)3↓+HCO3— |
| 所加试剂的关键是有效地将Na+、Al3+、Fe3+、Cu2+、Cl-分离并得到相应产品。若试剂1为足量的废铁屑,Fe与Cu2+、Fe3+、H+反应经过滤后得到含有Fe、Cu的沉淀A,向Fe、Cu混合物中加入足量的稀盐酸得到Cu和FeCl2,FeCl2再与H2O2反应得到FeCl3:2Fe2++H2O2+2H+=2Fe3++2H2O。溶液A中含有Na+、Al3+、Fe2+、Cl-,利用Al(OH)3的两性实现Fe2+、Al3+的分离,所以试剂3为过量的NaOH溶液,沉淀C为Fe(OH)2,其与盐酸反应生成FeCl2,再经步骤3可得FeCl3,溶液C为NaCl、NaOH、NaAlO2的混合液,向该溶液中通入过量的廉价CO2,可将AlO2—Al(OH)3沉淀,将得到的Al(OH)3沉淀加热即得到Al2O3,所得溶液D中含有NaCl、NaHCO3,再用盐酸调节其pH得到NaCl溶液,NaCl溶液经蒸发、结晶得到NaCl晶体。 |
相似问题
下列离子方程式 书写正确的是( )A.氯气溶于水:Cl2+H2O=2H++Cl-+ClO-B.硫酸
下列离子方程式,书写正确的是( )A.氯气溶于水:Cl2+H2O=2H++Cl-+ClO-B.硫酸铝溶液中加入足量氨水:Al3++4OH-=[Al(OH)4]-C.FeSO4溶液与
在200 mL 含Mg2+ Al3+ NH4+ H+ Cl-的溶液中 逐滴加入5 mol·L-1 N
在200 mL 含Mg2+、Al3+、NH4+、H+、Cl-的溶液中,逐滴加入5 mol·L-1 NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示
(14分)已知:A为含金属离子的淡黄色固体化台物 E X为空气中常见气体 A B C D含有相同的金
(14分)已知:A为含金属离子的淡黄色固体化台物,E、X为空气中常见气体,A、B、C、D含有相同的金属离子,其转化关系如下图(部分产物已略去)。请回答下
下列反应对应的离子方程式书写正确的是( )。A.漂白粉露置在空气中失效:ClO-+CO2+H2O=
下列反应对应的离子方程式书写正确的是()。A.漂白粉露置在空气中失效:ClO-+CO2+H2O=HClO+HCO3-B.氢氧化钡溶液与硫酸氢钠溶液反应后溶液恰好为
下列离子方程式与所述事实相符且正确的是( )A.漂白粉溶液在空气中失效:ClO-+CO2+H2O=
下列离子方程式与所述事实相符且正确的是()A.漂白粉溶液在空气中失效:ClO-+CO2+H2O=HClO+HCO3-B.用浓盐酸与MnO2反应制取少量氯气:MnO2+2H++












