已知铜在常温下能被稀硝酸溶解 其反应的化学方程式如下3Cu+8HNO3=3Cu(NO3)2+2NO↑
| 已知铜在常温下能被稀硝酸溶解,其反应的化学方程式如下 3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O (1)用双线桥法分析上述反应(只需标出电子得失的方向和数目)______ (2)上述反应中氧化剂是______,氧化产物是______; (3)硝酸在反应过程中起的作用是______、______;硝酸没有全部参加氧化还原反应,没有参加氧化还原反应的硝酸占总硝酸的______; (4)若反应中转移了0.6mol电子,产生的气体在标准状况下的体积是______. |
参考解答
| (1)在反应3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O中,Cu元素的化合价由0升高到+2价,N元素的化合价由+5降低为+2价,转移的电子为6e-, 则双线桥法标出电子得失的方向和数目为 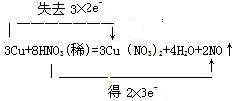 , 故答案为: 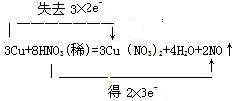 ; (2)N元素的化合价降低,Cu元素的化合价升高,则硝酸为氧化剂,硝酸铜为氧化产物, 故答案为:稀硝酸;硝酸铜; (3)生成硝酸盐体现硝酸的酸性,生成NO体现硝酸的氧化性,由反应及氮原子守恒可知,8mol硝酸反应时6mol硝酸体现酸性,2mol硝酸体现氧化性,则没有参加氧化还原反应的硝酸占总硝酸的
故答案为:氧化剂;酸;
(4)由反应可知生成2molNO转移的电子为6mol,则反应中转移了0.6mol电子,产生的气体的物质的量为0.2mol,其在标准状况下的体积为0.2mol×22.4L/mol=4.48L, 故答案为:4.48L. |
相似问题
有关氧化-还原反应的下列叙述 正确的是( )A.氧化剂发生还原反应 在反应中被还原B.一个氧化还原
有关氧化-还原反应的下列叙述,正确的是( )A.氧化剂发生还原反应,在反应中被还原B.一个氧化还原反应中,被氧化和被还原的元素可以是同一种元素C
高铁酸钾(K2FeO4)是一种新型 高效 多功能水处理剂 是比Cl2 O3 ClO2 KMnO4氧化
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,是比Cl2、O3、ClO2、KMnO4氧化性更强,无二次污染的绿色水处理剂.工业上是先制得高铁酸钠,然后
实验室中所用少量氯气是用下列方法制取的 4HCl(浓)+MnO2 △ . Cl2↑+MnCl2+
实验室中所用少量氯气是用下列方法制取的,4HCl(浓)+MnO2△ Cl2↑+MnCl2+2H2O试回答下列问题:(1)该反应是氧化还原反应吗?______,如果是氧化还原反
水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O32-+O2+xOH-=Fe3O4+S4O6
水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O32-+O2+xOH-=Fe3O4+S4O62-+2H2O,关于该反应下列说法中正确的是( )A.H2O和S4O62-都是还原产物B.Fe2+和
下列变化必须加入氧化剂才能完成的是( )A.KMnO4→MnO2B.Fe2+→Fe3+C.I2→I
下列变化必须加入氧化剂才能完成的是( )A.KMnO4→MnO2B.Fe2+→Fe3+C.I2→I-D.Cl2→ClO-












