实验室中所用少量氯气是用下列方法制取的 4HCl(浓)+MnO2 △ . Cl2↑+MnCl2+
| 实验室中所用少量氯气是用下列方法制取的, 4HCl(浓)+MnO2
试回答下列问题: (1)该反应是氧化还原反应吗?______,如果是氧化还原反应,请指出______是氧化剂,______是还原剂,写出该反应的离子方程式______. (2)集气瓶A中盛装的是饱和食盐水(注:氯气在饱和食盐水中溶解度很小,而氯化氢在饱和食盐水中的溶解度则很大),其作用是______. (3)氯气溶入水显酸性,且氯气有毒,并有剧烈的刺激性,若吸入大量氯气,可中毒死亡,所以氯气尾气直接排入大气中,会污染环境.实验室中可采用______溶液来吸收有毒的氯气. (4)一次实验中,用浓盐酸80mL,其密度为1.19g?cm-3、HCl的质量分数为36.5%,跟MnO2恰好完全反应,产生了5.6L(标准状况下)的氯气.试计算浓盐酸的物质的量浓度和被氧化的HCl的物质的量. 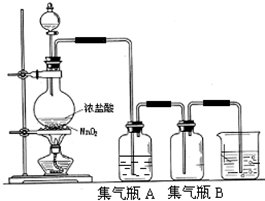 |
参考解答
(1)在反应4HCl(浓)+MnO2
故答案为:是;MnO2;HCl;4H++2Cl-+MnO2
(2)因氯气在饱和食盐水中溶解度很小,而氯化氢在饱和食盐水中的溶解度则很大,且浓盐酸易挥发,使生成的氯气中混有HCl,则饱和食盐水的作用为除去氯气中混有的HCl气体,故答案为:除去氯气中混有的HCl气体; (3)因氯气有毒,不能排放在环境中,且氯气能被碱吸收,则可利用浓氢氧化钠(浓碱)来处理尾气,故答案为:浓氢氧化钠(浓碱); (4)浓盐酸80mL,其密度为1.19g?cm-3、HCl的质量分数为36.5%,则浓盐酸的物质的量浓度是
由4HCl(浓)+MnO2
则被氧化的HCl的物质的量为
答:浓盐酸的物质的量浓度为11.9mol/L和被氧化的HCl的物质的量为0.5mol. |
相似问题
水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O32-+O2+xOH-=Fe3O4+S4O6
水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O32-+O2+xOH-=Fe3O4+S4O62-+2H2O,关于该反应下列说法中正确的是( )A.H2O和S4O62-都是还原产物B.Fe2+和
下列变化必须加入氧化剂才能完成的是( )A.KMnO4→MnO2B.Fe2+→Fe3+C.I2→I
下列变化必须加入氧化剂才能完成的是( )A.KMnO4→MnO2B.Fe2+→Fe3+C.I2→I-D.Cl2→ClO-
用双线桥表示下列反应中得失电子的情况 并按要求回答:3FeO+10HNO3=3Fe(NO3)3+NO
用双线桥表示下列反应中得失电子的情况,并按要求回答:3FeO+10HNO3=3Fe(NO3)3+NO↑+5H2O.(1)氧化剂是______;氧化产物是______.(2)在参加反应的
用双线桥标出下列反应方程式电子的转移方向和数目.2KMnO4+16HCl(浓)=2KCl+2MnCl
用双线桥标出下列反应方程式电子的转移方向和数目.2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,(1)氧化剂______,还原剂______,双线桥标出反应中电
科学家发现 食用虾类等水生甲壳类动物的同时服用维生素C容易中毒 这是因为对人体无害的+5价砷类物质在
科学家发现,食用虾类等水生甲壳类动物的同时服用维生素C容易中毒,这是因为对人体无害的+5价砷类物质在维生素C的作用下,能够转化为有毒的+3价含砷化合












