某地有软锰矿和闪锌矿两座矿山 它们的组成如下:软锰矿:MnO2含量≥65% SiO2含量约20% A
| 某地有软锰矿和闪锌矿两座矿山,它们的组成如下: 软锰矿:MnO2含量≥65%,SiO2含量约20%,Al2O3含量约4%,其余为水分; 闪锌矿:ZnS含量≥80%,FeS、CuS、SiO2含量约7%,其余为水分. 科研人员开发了综合利用这两种资源的同槽酸浸工艺,工艺流程如下图所示. 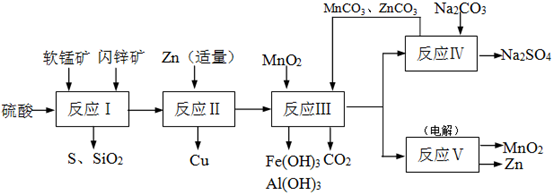 请回答下列问题: (1)反应Ⅰ的滤液中含有MnSO4、ZnSO4、CuSO4、Fe2(SO4)3、Al2(SO4)3等.试完成反应Ⅰ中生成CuSO4和MnSO4的化学方程式:MnO2+CuS+______=______↓+______+CuSO4+______. (2)反应Ⅱ加入适量锌的作用是______;如果锌过量,还会进一步发生反应的离子方程式为______.
(4)本工艺可以循环利用的物质有ZnCO3、MnCO3和______. |
参考解答
| (1)依据流程图分析判断,反应Ⅰ的滤液中含有MnSO4、ZnSO4、CuSO4、Fe2(SO4)3、Al2(SO4)3等,软锰矿和闪锌矿中的MnO2,CuS在酸性溶液中发生的氧化还原反应生成生成CuSO4和MnSO4硫单质,反应的化学方程式为:MnO2+CuS+2H2SO4=S↓+CuSO4+MnSO4+2H2O, 故答案为:2H2SO4;S;MnSO4;2H2O; (2)流程分析,反应Ⅰ的滤液中含有MnSO4、ZnSO4、CuSO4、Fe2(SO4)3、Al2(SO4)3等,加入锌反应生成铜,锌的主要作用是加入适量和铁离子反应生成亚铁离子,把铜离子转化为铜除去;锌过量会继续反应置换出铁;反应的离子方程式为:Zn+Fe2+=Fe+Zn2+,故答案为:将溶液中的硫酸铜转化为铜;Zn+Fe2+=Fe+Zn2+; (3)反应Ⅲ要调节pH生成Fe(OH)3、Al(OH)3,依据图表分析PH在 5.2~5.4范围内铁离子和铝离子全部沉淀,锌离子不沉淀;由流程图可知加入碳酸锰和碳酸锌与溶液中的氢离子反应用来调节溶液PH使铁离子和铝离子沉淀,故答案为:MnCO3 、ZnCO3;5.2~5.4; (4)依据流程图可知能循环使用的物质为ZnCO3、MnCO3和MnO2,故答案为:MnO2. |
相似问题
(6分)在反应Fe3O4 +4CO3Fe+4CO2中 是氧化剂 元素被氧化 氧
(6分)在反应Fe3O4 +4CO3Fe+4CO2中,是氧化剂,元素被氧化,氧化产物和还原产物的物质的量之比为,若生成的CO2在标准状况下为8 96L,则该反应中转移电子为mol。
(5分)右图为实验室某浓盐酸试剂瓶的标签上的有关数据 试回答下列问题:(1)该浓盐酸中HCl的物质的
(5分)右图为实验室某浓盐酸试剂瓶的标签上的有关数据,试回答下列问题:(1)该浓盐酸中HCl的物质的量浓度为mol L。若用KMnO4氧化上述 HCl。其反应方
(1)在新生代的海水里有一种铁细菌 它们提取海水中的亚铁离子 把它转变成它们的皮鞘(可以用Fe2O3
(1)在新生代的海水里有一种铁细菌,它们提取海水中的亚铁离子,把它转变成它们的皮鞘(可以用Fe2O3来表示其中的铁),后来便沉积下来形成铁矿;这个用
KClO3和浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯 其变化可表述为____KClO3+_
KClO3和浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯,其变化可表述为____KClO3+____HCl(浓)=____KCl+____ClO2↑+____Cl2↑+____H2O(1) 请配平
氧化还原反应实际上包含氧化和还原两个过程。(1)向氯酸钠的酸性水溶液中通入二氧化硫 该反应中氧化过程
氧化还原反应实际上包含氧化和还原两个过程。(1)向氯酸钠的酸性水溶液中通入二氧化硫,该反应中氧化过程的反应式为:SO2+2H2O - 2e- → SO42- + 4H












