A B C D E F六种元素 其中A B C D E为短周期主族元素。它们之间的关系如下:(Ⅰ)原
| A、B、C、D、E、F六种元素,其中A、B、C、D、E为短周期主族元素。它们之间的关系如下: (Ⅰ)原子半径:A < C < B < E < D (Ⅱ)原子的最外层电子数:A = D, C = E, A+B = C。 (Ⅲ)原子的核外电子层数:B = C = 2A (Ⅳ)B元素的主要化合价:最高正价+最低负价 = 2 (Ⅴ)F的单质或合金是用量最大的金属材料。 请回答:(1)甲由A、B两种元素按原子数之比为3:1组成的物质,写出其电子式 ; (2)写出某含F黑色的磁性氧化物与B最高价氧化物对应水化物的稀溶液反应的离子方程式: 。 (3)由A、C、E三种元素组成的两种气体化合物,相互反应能生成淡黄色固体的化学反应方程式为: 。 (4)上述元素中A、B、C、E、F的五种元素可形成一种常见复盐,经检测该复盐由三种离子组成且离子个数比为1:1:2,向该盐溶液加入酸化的BaCl2溶液,产生白色沉淀;加入NaOH溶液并加热,产生能使湿润红色石蕊试纸变蓝的气体,则该复盐的化学式为 。为检验该复盐中的某种有色离子存在,请写出实验的操作步骤和现象 ; (5)将上述复盐配成0.1L 0.1mol/L的溶液,向其中加入0.06mol的BaCl2固体完全反应后,该溶液中c(SO42-)为: (已知:忽略溶液体积变化。该沉淀的Ksp=2×10-9) |
参考解答
(1)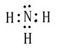 (2)3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O (3)SO2+2H2S=3S+2H2O (4)NH4Fe(SO4)2,向该盐溶液中加入硫氰化钾溶液,溶液变红则含有Fe3+ (5)5×10-9mol/l |
试题分析:根据题意可推知:A是H;B是N;C是O;D是Na;E是S;F是Fe。(1)甲是NH3,其电子式为 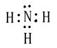 。(2)Fe3O4和稀硝酸反应的化学方程式为3Fe3O4+28HNO3=3Fe(NO3)3+NO↑+14H2O;将其改写为离子方程式为3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O。(3)(3)由H、O、S三种元素组成的两种气体相互反应能生成淡黄色固体的化学反应方程式为SO2+2H2S=3S+2H2O。(4)复盐是由两种不同的金属阳离子与一种酸根离子组成的化合物。向该盐溶液加入酸化的BaCl2溶液,产生白色沉淀,证明含有SO42-;加入NaOH溶液并加热,产生能使湿润红色石蕊试纸变蓝的气体,证明含有NH4+;另一种阳离子为Fe2+或Fe3+。因为该复盐由三种离子组成且离子个数比为1:1:2,根据在化合物中正负化合价的代数和为0,的原则,因此含有的另一种金属阳离子为Fe3+。该盐的化学式为NH4Fe(SO4)2。检验Fe3+的方法是取盐溶液少许,向该盐溶液中加入硫氰化钾溶液,若溶液变红则含有Fe3+。(5)n(Ba2+)=0.06mol,n(SO42-)=0.1×0.1×2mol=0.02mol.因为发生反应:Ba2++ SO42-=BaSO4↓。二者的物质的量的比为1:1,所以Ba2+过量,反应后溶液中的c(Ba2+)=(0.06-0.02)mol÷0.1L=0.4mol/L.由于BaSO4Ksp=2×10-9,所以 。(2)Fe3O4和稀硝酸反应的化学方程式为3Fe3O4+28HNO3=3Fe(NO3)3+NO↑+14H2O;将其改写为离子方程式为3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O。(3)(3)由H、O、S三种元素组成的两种气体相互反应能生成淡黄色固体的化学反应方程式为SO2+2H2S=3S+2H2O。(4)复盐是由两种不同的金属阳离子与一种酸根离子组成的化合物。向该盐溶液加入酸化的BaCl2溶液,产生白色沉淀,证明含有SO42-;加入NaOH溶液并加热,产生能使湿润红色石蕊试纸变蓝的气体,证明含有NH4+;另一种阳离子为Fe2+或Fe3+。因为该复盐由三种离子组成且离子个数比为1:1:2,根据在化合物中正负化合价的代数和为0,的原则,因此含有的另一种金属阳离子为Fe3+。该盐的化学式为NH4Fe(SO4)2。检验Fe3+的方法是取盐溶液少许,向该盐溶液中加入硫氰化钾溶液,若溶液变红则含有Fe3+。(5)n(Ba2+)=0.06mol,n(SO42-)=0.1×0.1×2mol=0.02mol.因为发生反应:Ba2++ SO42-=BaSO4↓。二者的物质的量的比为1:1,所以Ba2+过量,反应后溶液中的c(Ba2+)=(0.06-0.02)mol÷0.1L=0.4mol/L.由于BaSO4Ksp=2×10-9,所以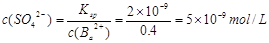 。 。 |
相似问题
液化石油气中常存在少量有毒气体羰基硫(COS) 必须将其脱除以减少环境污染和设备腐蚀。完成下列填空。
液化石油气中常存在少量有毒气体羰基硫(COS),必须将其脱除以减少环境污染和设备腐蚀。完成下列填空。(1)写出羰基硫的电子式,羰基硫分子属于(选填“
下列有关物质性质的比较 正确的是A.热稳定性:HF<HCl<HBrB.微粒半径: O2->Mg2+>
下列有关物质性质的比较,正确的是A.热稳定性:HF<HCl<HBrB.微粒半径: O2->Mg2+>Cl-C.第一电离能:Si>Al>MgD.电负性:Si>Al>Mg
某元素X 它的原子最外层电子数是次外层电子数的2倍 则X在周期表中位于( )。A.第二周期B.第三
某元素X,它的原子最外层电子数是次外层电子数的2倍,则X在周期表中位于( )。A.第二周期B.第三周期C.第ⅣA族D.第ⅥA族
钾(K)与Na在性质上具有很大的相似性 但K比Na的活泼性强 下面是根据Na的性质对K的性质的预测
钾(K)与Na在性质上具有很大的相似性,但K比Na的活泼性强,下面是根据Na的性质对K的性质的预测,其中正确的是( )A.K是银白色金属,硬度大,熔点高B.K
下列微粒半径大小比较正确的是:A.Na+<Mg2+<Al3+<O2-B.S2->Cl->Na+>Al
下列微粒半径大小比较正确的是:A.Na+<Mg2+<Al3+<O2-B.S2->Cl->Na+>Al3+C.Na<Mg<Al<SD.Ca<Rb<K<Na












