某研究性学习小组设计了一组实验验证元素周期律。(1)甲同学在a b c三只烧杯里分别加入50 mL水
| 某研究性学习小组设计了一组实验验证元素周期律。 (1)甲同学在a、b、c三只烧杯里分别加入50 mL水,再分别滴加几滴酚酞溶液,依次加入大小相近的锂、钠、钾块,观察现象。 ①甲同学设计实验的目的是________________________________________________; ②反应最剧烈的烧杯是_______(填字母); ③写出b烧杯里发生反应的离子方程式______ _____ __。 (2)乙同学设计实验验证非金属元素的非金属性越强,对应的最高价含氧酸的酸性就越强。他设计了下图装置以验证碳、氮、硅元素的非金属性强弱。 乙同学设计的实验可直接证明三种酸的酸性强弱,已知A是强酸,常温下可与铜反应;B是块状固体;打开分液漏斗的活塞后,C中可观察到白色沉淀生成。 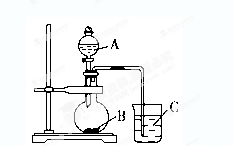 ①写出所选用物质的化学式:A、________; B、________;C、________。 ②写出烧瓶中发生反应的化学方程式: ___________________________________________________________。 ③写出烧杯中发生反应的化学方程式: ___________________________________________________________。 ④碳、氮、硅元素的非金属性强弱顺序为_______________________。 |
参考解答
| (Ⅰ) ①验证锂、钠、钾的活泼性(或同一主族,从上到下元素的金属性逐渐增强)(2分) ②c(2分) ③2 Na+2H2O=2Na++2OH—+H2↑(2分) (Ⅱ) ①CaCO3 (1分)Na2SiO3(或K2SiO3) (1分) ②2HNO3+CaCO3=Ca(NO3) 2+H2O+CO2↑(2分) ③CO2+H2O+Na2SiO3 =H2SiO3↓+Na2CO3(2分) 或2CO2+2H2O+Na2SiO3=H2SiO3↓+2NaHCO3 ④氮>碳>硅(1分) |
试题分析:钠与钾都属于碱金属元素位于第一主族。其最外层都为一个电子,都易失去电子表现出较强的还原性。其化学性质相似。本实验主要验证钠与钾的活泼性强弱的比较。据题意可知A为硝酸。B为碳酸钙。C为硅酸钠、硝酸与碳酸钙反应生成二氧化碳逸出到烧杯C中,烧杯中出现白色沉淀,这个白色沉淀应该是硅酸。硅酸是一种不溶于水的酸。所以非金属线由强到弱的顺序为;氮、碳、硅。 |
相似问题
4种短周期元素W X Y Z的原子序数依次增大 其原子的最外层电子数之和为19 W和X元素原子内质子
4种短周期元素W、X、Y、Z的原子序数依次增大,其原子的最外层电子数之和为19,W和X元素原子内质子数之比为1:2,X2+和Z-离子的电子数之差为8,下列说法
(8分)氧 硫 氯是中学化学重点研究的非金属元素 回答下列问题:⑴三种元素形成的常见氢化物中稳定性最
(8分)氧、硫、氯是中学化学重点研究的非金属元素,回答下列问题:⑴三种元素形成的常见氢化物中稳定性最差的是_______,沸点最高的是____,其沸点最高
【物质结构与性质】以氮化镓(GaN)为代表的第三代半导体材料目前已成为全球半导体研究的前沿和热点。回
【物质结构与性质】以氮化镓(GaN)为代表的第三代半导体材料目前已成为全球半导体研究的前沿和热点。回答下列问题:(1)镓为元素周期表第31号元素,镓原
(15分)元素周期表中第ⅦA族元素的单质及其化合物的用途广泛。(1)与氯元素同族的短周期元素的原子结
(15分)元素周期表中第ⅦA族元素的单质及其化合物的用途广泛。(1)与氯元素同族的短周期元素的原子结构示意图为。(2)能作为氯、溴、碘元素非金属性(原
【物质结构与性质】X Y Z M N Q为元素周期表前四周期的六种元素。其中X原子核外的M层中只有两
【物质结构与性质】X、Y、Z、M、N、Q为元素周期表前四周期的六种元素。其中X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地












