(12分)根据下列某些短周期元素中元素性质回答问题。 ①②③④⑤⑥⑦⑧⑨⑩原子半径/10 -10
(12分)根据下列某些短周期元素中元素性质回答问题。
(2)元素①和⑨形成阳离子 ,其结构式为__________________。 (3)某元素R的原子半径为1.02×10 -10m ,它与钠形成Na2R2,其电子式是_________(R用元素符号表示)。 (4)元素②和⑦形成晶体的部分结构可用下图中的_________来表示(填序号)。 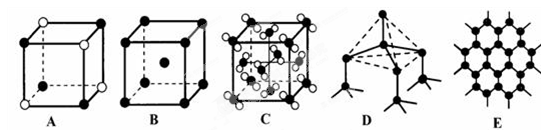 (5)①、③、⑨可以形成原子个数之比为4:3:2的中学常见无机化合物,该化合的水溶液显酸性的原因是_________________(用离子方程式表示),其水溶液中离子浓度由大到小的顺序是___________________。 |
参考解答
(1)H2O、NH3、PH3; (2) 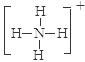 (3) (3)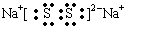 (4) A (4) A(5) NH4+ + H2O  NH3.H2O + H+ ; C(NO3--) > C(NH4+) > C( H+) > C(O H--) NH3.H2O + H+ ; C(NO3--) > C(NH4+) > C( H+) > C(O H--) |
| 试题分析:根据搞个的数据经方向可得:①是H;②是Na;③是O;④是Al;⑤是C;⑥是P;⑦是Cl;⑧是Na;⑨是N;⑩是F。(1)元素③、⑥和⑨的氢化物分别是H2O、PH3、 NH3;元素的非金属性O>N>P,这几种物质都是分子晶体。分子间通过分子间作用力结合。由于在H2O、NH3的分子之间除了存在分子间作用力外还存在氢键,增加了分子之间的相互作用,所以沸点最低的是PH3。由于O元素的非金属性比N强,所以H2O的氢键也强于NH3。因此三种物质中沸点由高到低的顺序是H2O> NH3>PH3。(2)元素H和N可形成阳离子NH4+ ,其结构式为  ;(3)某元素R的原子半径为1.02×10 -10m,介于P与Cl原子半径之间,所以该元素是S。所以它与钠形成Na2S2的电子式是 ;(3)某元素R的原子半径为1.02×10 -10m,介于P与Cl原子半径之间,所以该元素是S。所以它与钠形成Na2S2的电子式是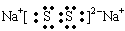 ;(4)元素Na和Cl形成NaCl晶体是离子晶体。阳离子与阴离子的配位数但是6个。其结构可用A表示。(5)H、O、N可以形成原子个数之比为4:3:2的中学常见无机化合物是NH4NO3,该物质是强酸弱碱盐,铵根离子水解消耗水电离产生的OH-,使溶液中的H+浓度增大,因此溶液显酸性。水解的离子方程式为NH4+ + H2O ;(4)元素Na和Cl形成NaCl晶体是离子晶体。阳离子与阴离子的配位数但是6个。其结构可用A表示。(5)H、O、N可以形成原子个数之比为4:3:2的中学常见无机化合物是NH4NO3,该物质是强酸弱碱盐,铵根离子水解消耗水电离产生的OH-,使溶液中的H+浓度增大,因此溶液显酸性。水解的离子方程式为NH4+ + H2O  NH3.H2O + H+ ; NH4NO3= NH4+ + NO3--。铵根离子水解消耗,所以C(NO3--) > C(NH4+);由于水解消耗了OH-,最终溶液中的H+浓度大于OH-的浓度。即C( H+) > C(O H--);盐的电离远大于弱电解质水的电离。因此C(NH4+) > C( H+)。综上所述,在溶液中离子浓度的关系是C(NO3--) > C(NH4+) > C( H+) > C(O H--)。 NH3.H2O + H+ ; NH4NO3= NH4+ + NO3--。铵根离子水解消耗,所以C(NO3--) > C(NH4+);由于水解消耗了OH-,最终溶液中的H+浓度大于OH-的浓度。即C( H+) > C(O H--);盐的电离远大于弱电解质水的电离。因此C(NH4+) > C( H+)。综上所述,在溶液中离子浓度的关系是C(NO3--) > C(NH4+) > C( H+) > C(O H--)。 |
相似问题
能说明氯的非金属性比硫强的事实是( )A.氯气与氢气反应生成氯化氢 而硫与氢气反应生成硫化氢B.
能说明氯的非金属性比硫强的事实是()A.氯气与氢气反应生成氯化氢,而硫与氢气反应生成硫化氢B.向硫化氢的水溶液中通入氯气可得到淡黄色的硫C.氯气能
下列各个曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数 Y为元素的有关性质)。把与下面元
下列各个曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。把与下面元素有关的性质相符的曲线标号填入相应的空格中:(1
下列叙述中正确的是A.同一主族元素的气态氢化物 其相对分子质量越大 对应的熔 沸点一定越高B.升高温
下列叙述中正确的是A.同一主族元素的气态氢化物,其相对分子质量越大,对应的熔、沸点一定越高B.升高温度可加快反应速率,其主要原因是反应物分子能量
已知A B两元素的原子序数在3~20之间 它们可形成离子化合物AmBn 若A的原子序数为a 则B的原
已知A、B两元素的原子序数在3~20之间,它们可形成离子化合物AmBn,若A的原子序数为a,则B的原子序数不可能为A.a+8-m-n B. a-16-m-n C.a+16-m-n D.a-m-n
(14分)元素单质及其化合物有广泛用途 请根据周期表中第三周期元素相关知识回答下列问题:(1)按原子
(14分)元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的












