过氧化钠(Na2O2)是中学常见物质。已知:过氧化钠与CO2反应有气体生成 而将SO2通入过氧化钠粉
| 过氧化钠(Na2O2)是中学常见物质。已知:过氧化钠与CO2反应有气体生成,而将SO2通入过氧化钠粉末中也有气体生成。有人提出CO2、SO2与过氧化钠的反应原理相同,但也有人提出SO2具有较强的还原性,能被过氧化钠氧化生成硫酸钠,CO2无强还原性,反应原理不相同。据此设计如下实验操作进行判断。 实验一:向一定量的过氧化钠固体中通入足量的SO2,取反应后的固体进行实验探究,以证明过氧化物与SO2反应的特点。 (1)提出假设:假设1:反应后固体中只有________,证明SO2未被氧化; 假设2:反应后固体中只有________,证明SO2完全被氧化; 假设3:__________________________证明______________________。 实验探究:实验二:通过测量气体的体积判断发生的化学反应,实验装置如下: 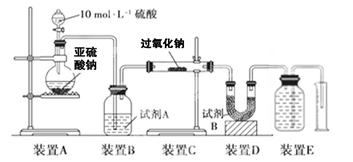 (2)试剂A可以选用________,试剂B的作用是________。 (3)实验测得装置C中过氧化钠质量增加了m1 g,装置D质量增加了m2 g,装置E中收集到的气体为V L(已换算成标准状况下),用上述有关测量数据判断, SO2未被氧化时、完全被氧化的V-m1关系式。 未被氧化:____________,完全被氧化:____________。 (4)若SO2完全被氧化,写出反应的化学方程式: __________________________。 |
参考解答
| (1)Na2SO3(1分) Na2SO4(1分) Na2SO3和Na2SO4的混合物(1分) SO2被部分氧化(1分) (2)浓H2SO4 (2分) 吸收未反应的SO2(2分) (3)V=7m1/30 (2分) V=0 (2分) (4)SO2+Na2O2= Na2SO4 (2分) |
试题分析:根据题目问题:(1)假设1:反应后固体只有 Na2SO3,证明SO2未被氧化;假设2:反应后固体中只有 Na2SO4,证明SO2完全被氧化;假设3:固体为Na2SO3和Na2SO4的混合物;证明SO2部分被氧化;实验二:(2)过氧化钠和水反应,装置A中试剂能吸收水蒸气,所以试剂为浓硫酸,干燥气体除去水蒸气;装置B为测定生成氧气的体积,需要把剩余的二氧化硫除去,因此试剂B装置作用是吸收未反应的SO2。(3)实验测得装置C中过氧化钠质量增加了m1 g,装置D质量增加了m2 g,装置E中收集到的气体为V L(已换算成标准状况下)。若SO2未被氧化、则发生反应:2Na2O2+2SO2=2Na2SO3+O2。依据化学方程式和反应增重计算E中收集的氧气,即 2Na2O2+2SO2=2Na2SO3+O2 反应增重 1mol 96g 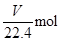 m1g m1g解得V= 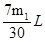 ;若二氧化硫全部被氧化发生的反应为:Na2O2+SO2=Na2SO4;反应过程中无氧气生成,V=0,若0<V< ;若二氧化硫全部被氧化发生的反应为:Na2O2+SO2=Na2SO4;反应过程中无氧气生成,V=0,若0<V<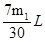 ,则二氧化硫部分被氧化。(4)二氧化硫完全被氧化生成硫酸钠,反应的化学方程式为:SO2+Na2O2═Na2SO4。2和过氧化钠反应的实验探究 ,则二氧化硫部分被氧化。(4)二氧化硫完全被氧化生成硫酸钠,反应的化学方程式为:SO2+Na2O2═Na2SO4。2和过氧化钠反应的实验探究 |
相似问题
把少量的如同绿豆大小的三块金属钠分别放入盛有下列液体的烧杯中 说明实验现象 并写出相应反应的化学方程
把少量的如同绿豆大小的三块金属钠分别放入盛有下列液体的烧杯中,说明实验现象,并写出相应反应的化学方程式。(1)钠放入饱和NaOH溶液中,现象是________
某同学设计了以下流程来检验碳酸钠粉末中可能含有少量氯化钠和氢氧化钠中的一种或两种杂质。(1)步骤1所
某同学设计了以下流程来检验碳酸钠粉末中可能含有少量氯化钠和氢氧化钠中的一种或两种杂质。(1)步骤1所需玻璃仪器是______;步骤3的操作名称是______。(2
下列金属分别投入冷水中 能产生气体的是[ ]A.FeB.AlC.NaD.Zn
下列金属分别投入冷水中,能产生气体的是[ ]A.FeB.AlC.NaD.Zn
下列物质不能由相应的单质直接反应制取的是( )A.Na2O2B.FeCl3C.Na2OD.FeCl
下列物质不能由相应的单质直接反应制取的是( )A.Na2O2B.FeCl3C.Na2OD.FeCl2
某小组的同学对放置已久的过氧化钠的成分进行探究 请回答下列问题:(1)反应2Na2O2+2H2O==
某小组的同学对放置已久的过氧化钠的成分进行探究,请回答下列问题:(1)反应2Na2O2+2H2O===4NaOH+O2↑的还原剂是________(写化学式);反应2Na2O2+2CO2












