有人设计一个Na2O2与CO2反应实验装置图如下:打开止水夹 发现CO2通过裹有Na2O2的脱脂棉
有人设计一个Na2O2与CO2反应实验装置图如下: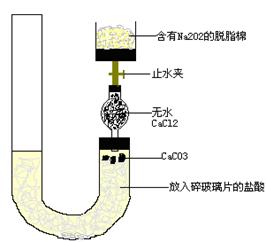 打开止水夹,发现CO2通过裹有Na2O2的脱脂棉,可观察到脱脂棉剧烈燃烧起来. (1)由实验现象所得出的有关Na2O2与CO2反应的结论是: a:有氧气生成:b: (2)甲、乙两位同学各称取质量为m g的过氧化钠与二氧化碳反应后的样品,并用下图所示仪器测定样品的组分。 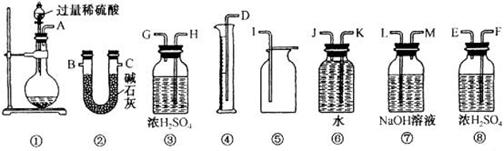 请回答下列问题: ①甲同学通过实验测得的数据是氧气的体积,该同学读取实验数据时应注意冷却至室温、____________、眼睛视线与凹液面最低处相切。 ②乙同学通过连接仪器①②进行实验,他测得的数据是 。按他测得的数据计算出的实验结果偏高,理由是 。 ③为了测得准确的实验数据,请你将乙同学的实验装置进行改进(每种仪器只准使用一次),写出各仪器接口的连接顺序 。 ④按③设计的实验装置进行实验,若测得实验前后装置②的质量分别是w1 g和w2 g,则样品中碳酸钠的质量分数为 。 ⑤在③的改进装置中由于受到仪器的局限,是否也有不足之处 (若没有,此空不必回答;若有,请一并说出不足的理由) 。 |
参考解答
| (1)b:该反应是放热反应。(2)①调节④⑥液面高度相同②二氧化碳的质量; 气体中的水蒸气被碱石灰吸收,同时空气中的二氧化碳和水蒸气也被碱石灰吸收。 ③A→H→G→B→C→F→E或A→F→E→B→C→H→G(B、C可交换) ④ 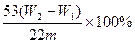 (2分) (2分)⑤ 有(2分),装置中二氧化碳不能全部被碱石灰吸收(2分) |
本题主要是探究Na2O2和CO2反应的实质。⑴Na2O2遇CO2能使脱脂棉剧烈燃烧起来,从燃烧的条件可知,必须有氧气生成,而且该反应还要放出大量的热。(2)本题涉及定量测气体体积与气体质量的区别。若通过实验测得氧气的体积,则应采用排液量气装置,因为反应生成的是氧气和二氧化碳的混合气体,先除杂,再量气。若通过实验测得二氧化碳的质量,则必须保证反应产生的二氧化碳全部被碱石灰吸收,但如果只连接①②,则反应产生的水蒸气以及空气中的水蒸气、二氧化碳也可能被碱石灰吸收,使结果偏大,如果改进应该在②前后分别加上干燥装置即可,另外实验中还缺少鼓气装置,最后体系中残留的气体不能被碱石灰吸收。利用生成CO2求解Na2CO3质量分数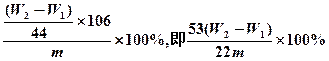 |
相似问题
下列关于钠用途的叙述中 不正确的是A.钠可用于制造高压钠灯 用于照明B.钠可用于制造过氧化钠等化合物
下列关于钠用途的叙述中,不正确的是A.钠可用于制造高压钠灯,用于照明B.钠可用于制造过氧化钠等化合物C.钠和钾组成的合金可作为原子反应堆的导热剂D
等物质的量的Na2CO3和NaHCO3分别与足量的同浓度盐酸溶液充分反应 其中A.Na2CO3放出的
等物质的量的Na2CO3和NaHCO3分别与足量的同浓度盐酸溶液充分反应,其中A.Na2CO3放出的CO2多B.NaHCO3放出的CO2多C.Na2CO3放出CO2的速度快D.NaHCO3放出CO2的速度快
下列关于Na2O2的叙述正确的是 ( )A.Na2O2是淡黄色固体
下列关于Na2O2的叙述正确的是( )A.Na2O2是淡黄色固体,久置于空气中变成Na2OB.Na2O2与水的反应中,Na2O2只作氧化剂C.用Na2O2漂白过的织物、麦杆
向0.1 mol·L-1NaOH溶液中通入过量CO2后 溶液中存在的主要离子是( )A.Na+
向0 1 mol·L-1NaOH溶液中通入过量CO2后,溶液中存在的主要离子是( )A.Na+、CO2-3B.Na+、HCO上标-3C.HCO、COD.Na+、OH-
用金属钠制取氧化钠通常采用下法:2NaNO2+6Na=4Na2O+N2↑ 试说明为什么用此法制取氧化
用金属钠制取氧化钠通常采用下法:2NaNO2+6Na=4Na2O+N2↑,试说明为什么用此法制取氧化钠比直接钠氧化法好。












