用金属钠制取氧化钠通常采用下法:2NaNO2+6Na=4Na2O+N2↑ 试说明为什么用此法制取氧化
| 用金属钠制取氧化钠通常采用下法:2NaNO2+6Na=4Na2O+N2↑,试说明为什么用此法制取氧化钠比直接钠氧化法好。 |
参考解答
Na2O在N2气中不被氧化,从而分析出Na直接氧化法不足之处;无论金属钠是在氧气中点燃,还是在空气中氧化,因生成的Na2O极不稳定,会进一步氧化生成Na2O2,即2Na+O2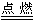 Na2O2,而实际上得不到纯Na2O。 Na2O2,而实际上得不到纯Na2O。 |
这题属于信息给予题,解答中必须紧扣题干Na2O制取反应式:2NaNO2+6Na=4Na2O+N2↑,反应中生成N2这一重要信息,才可找出答案:Na2O在N2气中不被氧化,从而分析出Na直接氧化法不足之处;无论金属钠是在氧气中点燃,还是在空气中氧化,因生成的Na2O极不稳定,会进一步氧化生成Na2O2,即2Na+O2 Na2O2,而实际上得不到纯Na2O。 Na2O2,而实际上得不到纯Na2O。 |
相似问题
将200 g NaHCO3和78 g Na2O2混合后放在密闭容器中加热使之充分反应 然后趁热排出气
将200 g NaHCO3和78 g Na2O2混合后放在密闭容器中加热使之充分反应,然后趁热排出气体物质,则容器中残留物的成分是()A.Na2O2和NaHCO3B.NaHCO3和
质量分数相等的Na2CO3和NaHCO3的混合物x g 加热一段时间后质量变为y g 当NaHCO3
质量分数相等的Na2CO3和NaHCO3的混合物x g,加热一段时间后质量变为y g,当NaHCO3完全分解时,y值等于( )A.B.C.D.
下列说法中 正确的是 [ ]A. 硅的化学性质不活泼 在自然界中可以以游离态存在 B. N
下列说法中,正确的是 [ ]A 硅的化学性质不活泼,在自然界中可以以游离态存在 B Na2O和Na2O2组成元素相同,且都能与硫酸溶液反应 C 工业上制备
向紫色石蕊试液中加入过量的Na2O2粉末振荡 可观察到的现象为( )A.溶液仍为紫色B.溶液最终
向紫色石蕊试液中加入过量的Na2O2粉末振荡,可观察到的现象为( )A.溶液仍为紫色B.溶液最终变蓝色C.最终溶液褪色,而无其他现象D.溶液中有气泡产生,
钠与水反应的过程如图所示.请回答:(1)钠与水反应的化学方程式为______.(2)根据B中的实验现
钠与水反应的过程如图所示.请回答:(1)钠与水反应的化学方程式为______.(2)根据B中的实验现象,说明钠的密度比水的______(填“大”或“小”).(












