氧是地壳中含量最多的元素。(1)氧元素基态原子核外未成对电子数为 个.(2)H2
| 氧是地壳中含量最多的元素。 (1)氧元素基态原子核外未成对电子数为 个. (2)H2O分子内的O-H键、分子间的范德华力和氢键从强到弱依次为 。 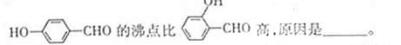 (3) H+可与H2O形成H3O+,H3O+中O原子采用 杂化。H3O+中H-O-H键角比H2O中H-O-H键角大,原因为 。 (4)CaO与NaCl的晶胞同为面心立方结构,已知CaO晶体密度为ag  cm-3, cm-3, 表示阿伏加德罗常数,则CaO晶胞体积为 Cm3。 表示阿伏加德罗常数,则CaO晶胞体积为 Cm3。 |
参考解答
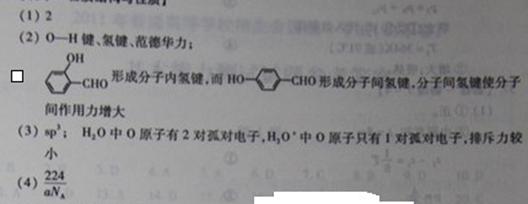 |
| 略 |
相似问题
(5分)选择以下物质填写下列空白:A.CO2B.NH4ClC.KOHD.Na2O2 E.MgCl2
(5分)选择以下物质填写下列空白:A.CO2B.NH4ClC.KOHD.Na2O2 E.MgCl2 F.NH3 G.H2O2⑴.含非极性共价键的离子化合物:___________________;⑵
下列物质的变化规律与共价键的键能大小有关的是()A.F2 Cl2 Br2 I2的熔点 沸点逐渐升高B
下列物质的变化规律与共价键的键能大小有关的是()A.F2、Cl2、Br2、I2的熔点、沸点逐渐升高B.HF、HCl、HBr、HI的热稳定性依次减弱C.NaF、NaCl、NaBr
已知Zn2+的4s轨道和4p轨道可以形成sp3型杂化轨道 那么[ZnCl4]2-的空间构型为A.直线
已知Zn2+的4s轨道和4p轨道可以形成sp3型杂化轨道,那么[ZnCl4]2-的空间构型为A.直线形B.平面正方形C.正四面体形D.正八面体形
50ml 0.5mol·L-1的盐酸与50ml 0.55mol·L-1的NaOH 溶液在下图所示的装
50ml 0 5mol·L-1的盐酸与50ml 0 55mol·L-1的NaOH 溶液在下图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。请回答下列
断裂下列化学键需要吸收的能量分别为:H-H:436 kJ/mol;Br-Br:200kJ/mol;H
断裂下列化学键需要吸收的能量分别为:H-H:436 kJ mol;Br-Br:200kJ mol;H-Br:369kJ mol。下列说法正确的是( )A.H2与Br2反应的热化学方程式为:H2(












