50ml 0.5mol·L-1的盐酸与50ml 0.55mol·L-1的NaOH 溶液在下图所示的装
| 50ml 0.5mol·L-1的盐酸与50ml 0.55mol·L-1的NaOH 溶液在下图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。 请回答下列问题: 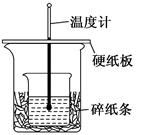 (l)从实验装置上看,由图可知该装置有不妥之处,应如何改正? 。 (2)烧杯间填满碎纸条的作用是 。 (3)如果不盖硬纸板,求得的中和热数值 (填“偏大”“偏小”“无影响”)。 (4)实验中改用 60 mL 0.50 mol· L-1的盐酸跟 50mL 0.55 mol· L-1的 NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”或“不相等”),所求中和热 (填“相等”或“不相等”)。 (5)用相同浓度和相同体积的氨水代替NaOH溶液进行上述实验,测得中和热的数值会 (填“偏大”“偏小”“无影响”); 简述理由 。 |
参考解答
| (l)增加环形玻璃搅拌棒;在大小烧杯间填满碎泡沫(或纸条); 使小烧杯口与大烧杯口相平 (2)减少实验过程中的热量损失 (3)偏小 (4)不等;相等; (5)偏小 因为弱电解质的电离需要吸热 |
| (l)从实验装置上看,由图可知该装置有不妥之处,应增加环形玻璃搅拌棒;在大小烧杯间填满碎泡沫(或纸条); (2)烧杯间填满碎纸条的作用是减少实验过程中的热量损失 (3)如果不盖硬纸板,热量会散失到空气中一部分,求得的中和热数值偏小。 (4)实验中改用 60 mL 0.50 mol· L-1的盐酸跟 50mL 0.55 mol· L-1的 NaOH溶液进行反应,与上述实验相比,所放出的热量不相等,反应物越多,放出的热量就越多。所求中和热相等,因为中和热是强酸、强碱的稀溶液反应生成1mol水时放出的热量,与反应物的多少无关,故所求中和热相等。 (5)用相同浓度和相同体积的氨水代替NaOH溶液进行上述实验,测得中和热的数值会偏小,因为弱电解质的电离需要吸热。 |
相似问题
断裂下列化学键需要吸收的能量分别为:H-H:436 kJ/mol;Br-Br:200kJ/mol;H
断裂下列化学键需要吸收的能量分别为:H-H:436 kJ mol;Br-Br:200kJ mol;H-Br:369kJ mol。下列说法正确的是( )A.H2与Br2反应的热化学方程式为:H2(
下列哪些实验事实不能说明有分子间作用力的存在 ( )
下列哪些实验事实不能说明有分子间作用力的存在()A.甲烷燃烧放出大量的热B.液氯汽化要吸收一定的能量C.降低温度氯气会凝结成液态D.增加压强CO2会凝
下列物质性质的变化规律 与共价键的键能大小有关的是( )A.F2 Cl2 Br2 I2的熔点
下列物质性质的变化规律,与共价键的键能大小有关的是()A.F2、Cl2、Br2、I2的熔点、沸点逐渐升高B.HF、HCl、HBr、HI的热稳定性依次减弱C.金属锂、钠
下列物质中 只含有离子键 不含有共价键的是( )A.HClB.KOHC.CaCl2D.CO2
下列物质中,只含有离子键,不含有共价键的是()A.HClB.KOHC.CaCl2D.CO2
0.80gCuSO4?5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示。请回
0 80gCuSO4?5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示。请回答下列问题:(1)试确定200℃时固体物质的化学式____________












