一水硫酸四氨合铜(Ⅱ)(化学式为[Cu(NH3)4]SO4·H2O)是一种重要的染料及农药中间体。某
一水硫酸四氨合铜(Ⅱ)(化学式为[Cu(NH3)4]SO4·H2O)是一种重要的染料及农药中间体。某学习小组以孔雀石(主要成分为Cu2(OH)2CO3,含少量Fe2O3和SiO2杂质)为原料制备该物质的流程如下: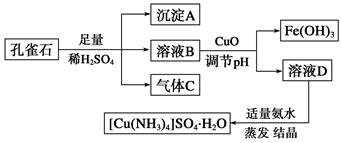 请回答: (1)沉淀A的晶体中最小环上的原子个数为________,气体C分子中σ键和π键的个数比为________。 (2)溶液D的溶质阴离子的空间构型为__________,其中心原子的杂化轨道类型为________。 (3)MgO的熔点高于CuO的原因为______________________________________。 (4)画出一水硫酸四氨合铜(Ⅱ)中配离子([Cu(NH3)4]2+)的配位键________________。 (5)一种铜金合金晶体具有面心立方最密堆积的结构。在晶胞中,Au原子位于顶点,Cu原子位于面心,则该合金中Au原子与Cu原子个数之比为 ,若该晶胞的边长为a pm,则合金的密度为 g·cm-3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。 |
参考解答
| (9分) (1)12 1∶1 (2)正四面体形 sp3 (3)MgO的晶格能大(其他合理答案也可) (4) 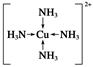 (5)1:3 (197+64×3)×1030/a3NA |
试题分析:(1)SiO2不与稀硫酸反应,故沉淀A是SiO2,SiO2是原子晶体,晶体中最小环上的原子个数为12。气体C是CO2,分子中σ键和π键的个数比为1:1。 (2)溶液D是CuSO4溶液,阴离子是SO42-,空间构型为正四面体形,中心原子的杂化轨道类型为sp3。 (3)MgO的熔点高于CuO的原因为MgO的晶格能比CuO的大。 (4)Cu2+周围有四个配位键,其图示为 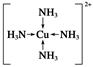 。 。(5)一种铜金合金晶体具有面心立方最密堆积的结构。在晶胞中,Au原子位于顶点,Cu原子位于面心,则该合金中Au原子与Cu原子个数之比为1:3,若该晶胞的边长为a pm,则合金的密度为(197+64×3)×1030/a3NA g·cm-3。 点评:金属及其重要化合物的主要性质、共价键、晶体等都是和实验有密切联系,认真复习课本中的实验,弄清实验原理、目的、要求、步骤和注意事项等实验基础知识,并能做到举一反三,是我们做好实验复习的保证。 |
相似问题
NH3分子空间构型是三角锥形 而CH4是正四面体形 这是因为A.NH3分子中N为sp2杂化 CH4分
NH3分子空间构型是三角锥形,而CH4是正四面体形,这是因为A.NH3分子中N为sp2杂化,CH4分子中C为sp3杂化B.NH3分子中N原子形成3个杂化轨道,CH4分子中C原
按下列要求写出由第二周期非金属元素组成的中性分子的相关内容:(1)平面三角形分子:分子式______
按下列要求写出由第二周期非金属元素组成的中性分子的相关内容:(1)平面三角形分子:分子式_____________,中心原子杂化方式是___________________。(
下列叙述正确的是( )A.P4和NO2都是共价化合物B.CCl4和NH3都是以极性键结合的极性
下列叙述正确的是()A.P4和NO2都是共价化合物B.CCl4和NH3都是以极性键结合的极性分子C.在CaO和SiO2晶体中,都不存在单个小分子D.在冰(固态水)中,既
下列说法正确的是( )A.N2 CS2 H2O CH4都是非极性分子B.SiO2 CsCl HCl
下列说法正确的是()A.N2、CS2、H2O、CH4都是非极性分子B.SiO2、CsCl、HCl、HF四种晶体的熔点逐渐降低C.CO2、PCl3、CCl4、CH4四种分子中,各原子都满
硫元素可以形成多种物质如 SO2 SO32- SO42-等。(1)中S原子的轨道杂化类型是 的
硫元素可以形成多种物质如、SO2、SO32-、SO42-等。(1)中S原子的轨道杂化类型是,的空间构型是。(2)向[Cu(NH3)4]SO4溶液中通入SO2至微酸性,有白色沉












