硫元素可以形成多种物质如 SO2 SO32- SO42-等。(1)中S原子的轨道杂化类型是 的
硫元素可以形成多种物质如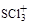 、SO2、SO32-、SO42-等。 、SO2、SO32-、SO42-等。(1) 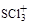 中S原子的轨道杂化类型是 , 中S原子的轨道杂化类型是 ,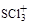 的空间构型是 。 的空间构型是 。(2)向[Cu(NH3)4]SO4溶液中通入SO2至微酸性,有白色沉淀生成。分析表明该沉淀中Cu、S、N的物质的量之比为1:1:1,经测定该沉淀的晶体里有一种三角锥型的阴离子和一种正四面体型的阳离子。 ①[Cu(NH3)4]SO4中Cu2+的电子排布式为 。 ②[Cu(NH3)4]SO4中存在的化学键类型有 (填序号)。
|
参考解答
(1)sp3 三角锥型 (2)①[Ar3d9 ②ACD (对一个给1分,全对给2分,只要有答案选错,该题得0分) ③SiCl4或SiF4 ④Cu(NH4)SO3 |
试题分析:(1)SCl3+中S原子的价电子对数为(6+3-1)/2=4,所以杂化类型为sp3,有3个配位原子,故空间构型是三角锥型;(2)②[Cu(NH3)4SO4为配合物,[Cu(NH3)42+存在配位键,內界与外界形成离子键,NH3、SO42-存在共价键;③等电子体是原子数和最外层电子总数相同微粒,一般在同一周期左右元素和同族上下找,与SO42-互为等电子体的一种分子SiCl4或SiF4 或CCl4等;④三角锥型的阴离子和一种正四面体型的阳离子只能是SO32-、NH4+,结合沉淀中Cu、S、N的物质的量之比为1:1:1,化学式为Cu(NH4)SO3 。 |
相似问题
-NMR(核磁共振)可以用于含碳化合物的结构分析有关的说法正确的是 [ ]A.质子数为6
-NMR(核磁共振)可以用于含碳化合物的结构分析有关的说法正确的是 [ ]A.质子数为6 B.电子数为13C.中子数为6 D.质量数为6
共价键 离子键和分子间作用力是构成物质微粒间的不同的作用方式 下列物质中只含有上述一种作用的是()A
共价键、离子键和分子间作用力是构成物质微粒间的不同的作用方式,下列物质中只含有上述一种作用的是()A.干冰B.氯化钠C.氢氧化钠D.碘
某元素二价阴离子核外有18个电子 质量数为32 该元素原子的原子核中的中子数[ ]A.12B
某元素二价阴离子核外有18个电子,质量数为32,该元素原子的原子核中的中子数[ ]A.12B.14C.16D.18
通过核裂变产生核能可以用于发电 是一种常用的核燃料 下列说法错误的是[ ]A.U元素的近似相
通过核裂变产生核能可以用于发电,是一种常用的核燃料,下列说法错误的是[ ]A.U元素的近似相对原子质量为235 B.中中子数比质子数多51 C.与的质量比
关于含正离子N5+的化合物N5ASF6 下列叙述中错误的是( )A.N5+共有34个核外电子 B.
关于含正离子N5+的化合物N5ASF6,下列叙述中错误的是()A.N5+共有34个核外电子 B.N5+中氮原子间以离子键结合C.化合物N5ASF6中AS的化合价为+1价 D.












