X Y Z是中学化学常见的三种元素 其中 X Z位于短周期.常温下 X单质为黄绿色气体;向含Y离子的
| X、Y、Z是中学化学常见的三种元素,其中,X、Z位于短周期.常温下,X单质为黄绿色气体;向含Y离子的溶液中滴加氢氧化钠溶液,生成白色絮状沉淀,迅速变为灰绿色,最后变为红褐色;Z的最外层电子数与核外电子总数之比为3:13.请回答下列问题: (1)Z在元素周期表中的位置是______,X单质分子的电子式是______. (2)Z单质与Y的氧化物在高温条件下反应是冶炼Y单质的一种方法,该反应化学方程式是______. (3)含上述元素的某些物质常用于处理工业废水,部分流程如图1: 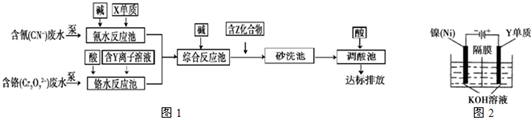 ①处理含铬废水时,在反应池中Cr2O72-变为Cr3+,当反应转移1mol 电子时,有______ mol Cr2O72- 转化(计算结果保留两位小数). ②含Z化合物可以使水中悬浮颗粒发生凝聚,原因是______(用文字和化学用语表示). ③处理含氰废水时,CN-最终转化为两种无毒的气体,该反应的离子方程式是______. (4)利用图2方法电解可得到一种新型净水剂K2YO4,阳极的电极反应式为______. |
参考解答
| 常温下,X单质为黄绿色气体应为Cl2,则X为Cl元素,向含Y离子的溶液中滴加氢氧化钠溶液,生成白色絮状沉淀,迅速变为灰绿色,最后变为红褐色,该红色沉淀为Fe(OH)3,则Y为Fe元素,Z的最外层电子数与核外电子总数之比为3:13,应为Al元素, (1)Z为Al元素,原子核外有3个电子层,最外层电子数为3,则应位于周期表三周期ⅢA族,X单质为Cl2,电子式为  , 故答案为:三周期ⅢA族,  ; (2)Z单质与Y的氧化物在高温条件下反应是冶炼Y单质,为Al和铁的氧化物的反应,为铝热反应,反应的可能方程式为Fe2O3+2Al
故答案为:Fe2O3+2Al
(3)①Cr2O72-变为Cr3+,化合价由+6价降低到+3价,当有1mol电子转移时,应有
故答案为:0.17; ②铝离子易水解产生氢氧化铝,反应的离子方程式为Al3++3H2O  Al(OH)3+3H+,氢氧化铝胶体,能吸附水中悬浮物,使之沉淀下来, 故答案为:Al3++3H2O  Al(OH)3+3H+,铝离子水解产生氢氧化铝胶体,能吸附水中悬浮物,使之沉淀下来; ③两种无毒的气体为二氧化碳和氢气,而反应物为CN-和Cl2,则反应氧化还原反应,反应的离子方程式为2CN-+5Cl2+8OH-=2CO2+N2+H2O+10Cl-, 故答案为:2CN-+5Cl2+8OH-=2CO2+N2+H2O+10Cl-; (4)阳极发生氧化反应,Fe被氧化为FeO42-,电极反应式为Fe-6e-+8OH-=FeO42-+4H2O, 故答案为:Fe-6e-+8OH-=FeO42-+4H2O. |
相似问题
A B C D E是原子序数依次增大的五种短周期元素.A原子的电子层数与它的核外电子总数相同 A与C
A、B、C、D、E是原子序数依次增大的五种短周期元素.A原子的电子层数与它的核外电子总数相同,A与C、B与D分别为同主族,B和C的最外层电子数之和与E的最外
元素X Y Z W均为短周期元素 且原子序数依次增大.已知Y原子最外层电子数占核外电子总数的 3/4
元素X、Y、Z、W均为短周期元素,且原子序数依次增大.已知Y原子最外层电子数占核外电子总数的3 4,W-、Z+、X+的离子半径逐渐减小,化合物XW常温下为气体
元素X和元素Y在周期表中位于相邻的两个周期 x与Y两原子核外电子总数之和为19 Y的原子核内质子数比
元素X和元素Y在周期表中位于相邻的两个周期,x与Y两原子核外电子总数之和为19,Y的原子核内质子数比X多3个.下列描述中不正确的是( )A.X与Y形成的
已知铬的核电荷数为24 以下是一些同学绘制的基态铬原子核外电子的轨道表示式(即电子排布图) 其 中最
已知铬的核电荷数为24,以下是一些同学绘制的基态铬原子核外电子的轨道表示式(即电子排布图),其 中最能准确表示基态铬原子核外电子运动状态的是 [ ]A B C D
X Y元素均为主族元素 aXm+和bYn-的电子层结构相同 下列叙述中错误的是( )A.Y的原子序
X、Y元素均为主族元素,aXm+和bYn-的电子层结构相同,下列叙述中错误的是( )A.Y的原子序数小于X的原子序数B.Y元素的核电荷数b等于a-m-nC.bYn-的












