已知部分短周期元素的性质及原子结构如下表所示 X~M的原子序数依次增大.元素代号原子结构或元素性质X
已知部分短周期元素的性质及原子结构如下表所示,X~M的原子序数依次增大.
(1)Y的元素符号为______,X的最高氧化物的化学式为______. (2)Z、L、M元素的简单离子半径由大到小的顺序为______(用离子符号表示). (3)写出M元素的最高价氧化物与L元素的最高价氧化物对应的水化物反应的化学方程式:______. |
参考解答
| X元素最高正价=|最低负价|,说明X位于第IVA族; Y原子核及核外各层电子的排布情况如图: 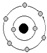 ,Y原子核外电子数为8,则Y为O元素,X的原子序数小于Y,所以X为C元素; ,Y原子核外电子数为8,则Y为O元素,X的原子序数小于Y,所以X为C元素;Z原子结构示意图: 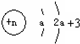 ,K电子层最多排列2个电子,所以a=2,L电子层电子数为7,则Z原子核外有9个电子,为F元素; ,K电子层最多排列2个电子,所以a=2,L电子层电子数为7,则Z原子核外有9个电子,为F元素;L原子半径为同周期主族元素中最大,且该元素为短周期元素,其原子序数大于F元素,所以L为Na元素; M原子序数比L大2,则M元素为Al元素, (1)Y的元素符号为O,X的最高氧化物为二氧化碳,二氧化碳的化学式为CO2,故答案为:O;CO2; (2)Z、L、M元素分别是F、Na、Al元素,这三种元素形成的简单离子电子层结构相同,电子层结构相同的离子其离子半径随着原子序数的增大而减小,所以这三种元素的简单离子半径由大到小的顺序为F->Na+>Al3+, 故答案为:F->Na+>Al3+; (3)M元素的最高价氧化物为Al2O3,L元素的最高价氧化物对应的水化物为NaOH,氢氧化钠溶液和氧化铝反应生成偏铝酸钠和水,所以反应的化学方程式:Al2O3+2NaOH=2NaAlO2+H2O,故答案为:Al2O3+2NaOH=2NaAlO2+H2O. |
相似问题
aXn-和bYm+为两主族元素的离子 它们的电子层结构相同 下列判断错误的是( )A.原子半径X<
aXn-和bYm+为两主族元素的离子,它们的电子层结构相同,下列判断错误的是( )A.原子半径X<YB.a+n=b-mC.Y最高价氧化物的化学式为YOmD.X的氢化物的化学式为HnX
以下表示氦原子结构的化学用语中 对电子运动状态描述最详尽的是 [ ]A. B.C. 1s2D
以下表示氦原子结构的化学用语中,对电子运动状态描述最详尽的是 [ ]A B C 1s2D
有A B C D E五种短周期元素 它们的原子序数依次增大 已知A和B原子有相同的电子层数 且A的最
有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,已知A和B原子有相同的电子层数,且A的最外层电子数是次外层电子数的两倍,C是该周期中原子半径
金属钛对人体无毒且惰性 能与肌肉和骨骼生长在一起 有“生物金属”之称.下列有关 4822Ti和 50
金属钛对人体无毒且惰性,能与肌肉和骨骼生长在一起,有“生物金属”之称.下列有关4822Ti和5022Ti的说法中正确的是( )A.4822Ti和5022Ti原子中均含
A B C D E五种短周期元素 其原子序数依次增大 而原子半径按A C B E D顺序依次增大.A
A、B、C、D、E五种短周期元素,其原子序数依次增大,而原子半径按A、C、B、E、D顺序依次增大.A、D同主族;B、D、E三种元素原子的最外层电子数之和为10;












