0.15mol某金属单质与足量的稀硫酸充分作用后 在标准状况下生正确成5.04LH2和25.65g该
| 0.15mol某金属单质与足量的稀硫酸充分作用后,在标准状况下生正确成5.04LH2和25.65g该金属的硫酸盐,若该金属原子核内的质子数比中子数少一个,试通过计算推导该金属元素在周期表中的位置? |
参考解答
| 标准状况下生成5.04LH2物质的量为0.225mol,质量为0.45g,需要H2SO40.225mol参与反应,H2SO4质量为22.05g, 则0.15mol金属单质的质量为 25.65g+0.45g-22.05=4.05g(生成物质量等于反应物的质量),所以金属的摩尔质量为
又因为原子核内的质子数比中子数少一个,所以金属元素原子核内的质子为
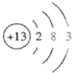 ,位于第三周期,第ⅢA族. 故答案为:第三周期,第ⅢA族 |
相似问题
A B C D是四种短周期元素 它们的相关信息如下表:元素元素性质及相关信息A其单质的一种晶体虽不是
A、B、C、D是四种短周期元素,它们的相关信息如下表:元素元素性质及相关信息A其单质的一种晶体虽不是金属晶体,但是电的良导体,且难熔、质软并有润滑性
(附加题)R Q X Y Z均为短周期元素 且原子序数依次增大.已知Q元素在自然界中组成的化合物种类
(附加题)R、Q、X、Y、Z均为短周期元素,且原子序数依次增大.已知Q元素在自然界中组成的化合物种类最多;Y原子最外层电子数与核外电子数之比为3:4;R
已知5种短周期元素的原子序数大小顺序是C>A>B>D>E;A C同周期 B C同主族;A与B形成的离
已知5种短周期元素的原子序数大小顺序是C>A>B>D>E;A、C同周期,B、C同主族;A与B形成的离子化合物A2B中,离子的电子数相同,其电子总数为30;D和E可
短周期主族元素A B C D的原子序数依次增大 其中A C同主族 B C D同周期 A原子的最外层电
短周期主族元素A、B、C、D的原子序数依次增大,其中A、C同主族,B、C、D同周期,A原子的最外层电子数是次外层电子数的3倍,B是短周期元素中原子半径最大
已知1-18号元素的离子aW3+ bX+ cY2- dZ-都具有相同的电子层结构 下列关系正确的是(
已知1-18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是( )A.离子的还原性:Y2->Z-B.原子序数:c>bC.氢化物的稳












