乙炔是有机合成工业的一种原料。工业上曾用CaC2与水反应生成乙炔。(1)CaC2与水反应生成乙炔的化
| 乙炔是有机合成工业的一种原料。工业上曾用CaC2与水反应生成乙炔。 (1)CaC2与水反应生成乙炔的化学方程式_________________;CaC2中C22-与O22+互为等电子体,O22+的电子式可表示为 ____________________________。 (2)乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N)。丙烯腈分子中碳原子轨道杂化类型是__________;分子中处于同一直线上的原子数目最多为_________。 (3)金刚石的晶胞如图所示,已知六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,立方氮化硼晶体密度为ag/cm3, 表示阿伏加德罗常数,则立方氮化硼晶胞体积为_______cm3。 |
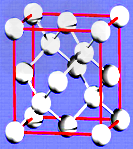 |
参考解答
(1)CaC2+2H2O→Ca(OH)2+C2H2↑;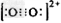 (2)sp杂化、sp2杂化;3 (3)100/aNA |
相似问题
下列分子含有“手性”碳原子 属于手性分子的是( )A.CH3CH2OHB.CH3CHOC.D.H2
下列分子含有“手性”碳原子,属于手性分子的是( )A.CH3CH2OHB.CH3CHOC.D.H2N-CH2-COOH
下列分子中 属于非极性的是 [ ]A.SO2B.BaCl2C.BBr3 D.COCl2
下列分子中,属于非极性的是 [ ]A SO2B BaCl2C BBr3 D COCl2
已知a b x y z五种元素的原子序数依次增大 其中a原子的半径是所有原子中半径最小的 b原子中的
已知a、b、x、y、z五种元素的原子序数依次增大,其中a原子的半径是所有原子中半径最小的,b原子中的电子有6种不同的运动状态,y原子的L层有2对成对电子,
试用杂化轨道理论说明下列分子或离子的几何构型。 (1)CO2______ (2)SiF4______
试用杂化轨道理论说明下列分子或离子的几何构型。 (1)CO2______ (2)SiF4______(3)BCl3______ (4)NF3______(5)NO2-______
NH3 H2S等是极性键构成的极性分子 CO2 BF3 CCl4等是极性键构成的非极性分子.根据上述
NH3、H2S等是极性键构成的极性分子,CO2、BF3、CCl4等是极性键构成的非极性分子.根据上述事实,通过比较归纳可推出ABn型分子是非极性分子的经验规律是(












