已知a b x y z五种元素的原子序数依次增大 其中a原子的半径是所有原子中半径最小的 b原子中的
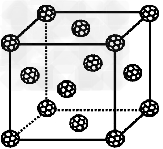
| 已知a、b、x、y、z五种元素的原子序数依次增大,其中a原子的半径是所有原子中半径最小的,b原子中的电子有6种不同的运动状态,y原子的L层有2对成对电子,z元素的电负性是前四周期中最小的。 (1)x、y两种元素的第一电离能的大小为x________y(填“>”、“<”或“=”),用原子结构的知识解释原因________________________; (2)固体物质M的化学式为xa5 ,它的所有原子最外层都符合相应的稀有气体原子的最外电子层结构。则该化合物中a元素的化合价为_______和______;该化合物中x原子的杂化方式为__________; (3)如果把晶胞顶点与最近三个面心所围成的空隙叫做四面体空隙,z原子可作为容体掺入C60晶体的空隙中,形成具有良好的超导性的掺杂C60化合物。现把C60 抽象成质点,该晶体的晶胞结构如图所示,若每个四面体空隙填入一个z元素的原子,则 z元素全部填满C60晶体的四面体空隙后,所形成的掺杂C60化合物的化学式为_____________。 |
 |
参考解答
| (1)>;O原子的价电子排布为2s22p4,N原子的价电子排布为2s22p3,p轨道为半充满比较稳定,比氧原子难以失去电子 (2)+1;-1; sp3 (4)K2C60 |
相似问题
试用杂化轨道理论说明下列分子或离子的几何构型。 (1)CO2______ (2)SiF4______
试用杂化轨道理论说明下列分子或离子的几何构型。 (1)CO2______ (2)SiF4______(3)BCl3______ (4)NF3______(5)NO2-______
NH3 H2S等是极性键构成的极性分子 CO2 BF3 CCl4等是极性键构成的非极性分子.根据上述
NH3、H2S等是极性键构成的极性分子,CO2、BF3、CCl4等是极性键构成的非极性分子.根据上述事实,通过比较归纳可推出ABn型分子是非极性分子的经验规律是(
下列分子的中心原子发生sp2杂化的是( )A.CH4B.NH3C.H2OD.BF3
下列分子的中心原子发生sp2杂化的是( )A.CH4B.NH3C.H2OD.BF3
下列叙述中正确的是( )A.某非金属元素从游离态变成化合态时 该元素一定被还原B.气态氢化物的稳定
下列叙述中正确的是( )A.某非金属元素从游离态变成化合态时,该元素一定被还原B.气态氢化物的稳定性:HF>HCl,是因为H-F的键能大于H-ClC.NF3分
T X Y Z Q R P W为周期表前四周期元素 原子序数依次递增 其相关信息如表:元素
T、X、Y、Z、Q、R、P、W为周期表前四周期元素,原子序数依次递增,其相关信息如表:元素 相 关 信 息 TT原子所处的周期数、族序数分别与其原子序数












