锌是一种重要的金属 锌及其化合物有着广泛的应用.①指出锌在周期表中的位置:第______周期 第__
| 锌是一种重要的金属,锌及其化合物有着广泛的应用. ①指出锌在周期表中的位置:第______周期,第______族,属于______区. ②葡萄糖酸锌[CH2OH(CHOH)4COO]2Zn是目前市场上流行的补锌剂.写出Zn2+基态电子排布式______;葡萄糖分子中碳原子杂化方式有______. ③Zn2+能与NH3形成配离子[Zn(NH3)4]2+.配位体NH3分子属于______(填“极性分子”或“非极性分子”);在[Zn(NH3)4]2+中,Zn2+位于正四面体中心,N位于正四面体的顶点,试在图1中表示出[Zn(NH3)4]2+中Zn2+与N之间的化学键. 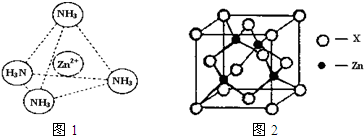 ④如图2表示锌与某非金属元素X形成的化合物晶胞,其中Zn和X通过共价键结合,该化合物的化学式为______;该化合物晶体的熔点比干冰______(填写“高”或“低”),原因是______. |
参考解答
| ①Zn的原子序数是30,其电子排布式为:1s22s22p63s23p63d104s2,由电子排布式可知该元素为第四周期,第ⅡB族ds区,故答案为:四;ⅡB;ds; ②Zn2+基态电子排布式为:1s22s22p63s23p63d10或[Ar3d10 ,葡萄糖里有两种碳原子,葡萄糖是无羟基醛,所以,一种是以sp3杂化(接羟基的碳),一种是以sp2杂化(醛基里的碳), 故答案为:1s22s22p63s23p63d10或[Ar3d10;sp2、sp3; ③配位体NH3分子中正负电荷中心不重合,从整个分子来看,电荷的分布是不均匀的,不对称的,是极性分子;[Zn(NH3)42+中Zn2+与N之间的化学键是配位键,故答案为:极性分子; 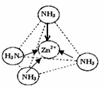 ; ④晶胞中锌的个数为4,X的个数为4,化学式为ZnX,该化合物是立体网状结构是原子晶体,而干冰是分子晶体,故该化合物的熔点比干冰高得多, 故答案为:ZnX;高;该化合物是原子晶体,而干冰是分子晶体. |
相似问题
下列说法正确的是( )①具有规则几何外形的固体一定是晶体 ②NaCl晶体中与每个Na+距
下列说法正确的是( )①具有规则几何外形的固体一定是晶体 ②NaCl晶体中与每个Na+距离相等且最近的Na+共有12个③非极性分子中一定含有非极性键 ④
下列分子中属于含有极性键的非极性分子 且分子中各原子最外层都满足8电子稳定结构的是( )A.CH4
下列分子中属于含有极性键的非极性分子,且分子中各原子最外层都满足8电子稳定结构的是( )A.CH4B.PCl3C.SiCl4D.XeF4
用一带静电的有机玻璃棒靠近A B两种纯液体的细流 现象如图所示。据此分析A B两种液体分子的极性正确
用一带静电的有机玻璃棒靠近A、B两种纯液体的细流,现象如图所示。据此分析A、B两种液体分子的极性正确的是 [ ]A A是极性分子,B是非极性分子 B A是非
在BrCH=CHBr分子中 C-Br键采用的成键轨道是( )A.sp-pB.sp2-sC.sp2-
在BrCH=CHBr分子中,C-Br键采用的成键轨道是( )A.sp-pB.sp2-sC.sp2-pD.sp3-p
下列有关说法错误的是( )A.H2O NH3 CH4分子的中心原子均为SP3杂化轨道类型B.P S
下列有关说法错误的是( )A.H2O、NH3、CH4分子的中心原子均为SP3杂化轨道类型B.P、S、Cl元素的最高化合价依次升高C.N、O、F电负性依次增大D.Na、












