(11分)T X Y Z Q R W为周期表前四周期元素 原子序数依次递增 其中某些元素的相关信息如
(11分)T、X、Y、Z、Q、R、W为周期表前四周期元素,原子序数依次递增,其中某些元素的相关信息如下表:
(2)X与Y原子结合形成的X3Y4晶体,晶体结构与金刚石类似,则X3Y4晶体的熔点比金刚石要 (填“高”、“低”)。 (3)W2+的核外电子排布式为 。元素W与人体分泌物中的盐酸以及空气反应可生成超氧酸:W+HCl+O2=WCl+HO2,HO2(超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性。下列说法或表示错误的是 A.氧化剂是O2 B.HO2在碱中不能稳定存在 C.氧化产物是HO2 D.1 molW参加反应有1 mol电子发生转移 (4)X、Y、Z分别与氢元素可以构成A、B、C、D等多种粒子。其中A、B、C均为10电子微粒,D为18电子微粒。A为5原子核的+1价阳离子,则A+的中心原子杂化方式为_______. B为4原子核的+1价阳离子,则B+电子式为___________。C为4个原子核构成的分子,则与C互为等电子体的分子可以是_______(写结构式)。D分子中两元素的原子个数之比为1:1,则D为 (填“极性”或“非极性”)分子。某双原子单质分子E也为18电子微粒,E与水的反应的化学方程式为______________________。 (5)已知25℃、101 kPa条件下: 4R(s)+3Z2(g) 4R(s)+2Z3(g) 则16g Z2(g)完全转化为Z3(g)的△H= . |
参考解答
| 1)N>C>Na (2)高 (3)[Ar3d9或1s22s22p63s23p63d9;C (4)sp3 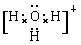 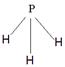 , 极性 2F2+2H2O=4HF+O2 , 极性 2F2+2H2O=4HF+O2(5)+47.2 kJ/mol(2分) |
| 根据元素的结构及其性质可知,T、X、Y、Z、Q、R、W分别是H、C、N、O、Na、Al、Cu。 (1)非金属性越强,电负性越大,所以X、Y、Q三种元素的电负性由大到小的顺序是N>C>Na。 (2),晶体结构与金刚石类似,石墨是原子晶体。由于碳原子半径大于氮原子半径,原子半径越小,共价键越强,所以该晶体的熔点大于金刚石的。 (3)根据构造原理可知,铜离子的电子排布式为[Ar3d9或1s22s22p63s23p63d9。根据方程式可知,氧气是氧化剂,所以HO2是还原产物,选项C不正确,其余都是正确的,答案选C。 (4)A为5原子核的+1价阳离子,则A是NH4+,氮原子是sp3杂化。B为4原子核的+1价阳离子,则B是H3O+,其电子式为 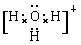 。C为4个原子核构成的分子,则C是氨气,所以与氨气互为等电子体的分子可以是PH3,其结构式为 。C为4个原子核构成的分子,则C是氨气,所以与氨气互为等电子体的分子可以是PH3,其结构式为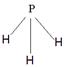 。D是双氧水,属于极性分子。E应该是是单质氟,和水反应的方程式为2F2+2H2O=4HF+O2。 。D是双氧水,属于极性分子。E应该是是单质氟,和水反应的方程式为2F2+2H2O=4HF+O2。(5)考查盖斯定律的应用。①-②即得到3Z2(g) |
相似问题
物质的熔沸点高低能用键能大小解释的是A.Na > KB.O2> N2C.H2O > H2SD.SiO
物质的熔沸点高低能用键能大小解释的是A.Na > KB.O2> N2C.H2O > H2SD.SiO2 > CO2
下表中给出几种氯化物的熔点和沸点: NaClMgCl2AlCl3SiCl4熔点(℃)80171419
下表中给出几种氯化物的熔点和沸点:NaClMgCl2AlCl3SiCl4熔点(℃)801714190—70沸点(℃)1413141218057.57有关表中所列四种氯化物的性质,有以下叙述
下面的排序不正确的是A.晶体熔点由低到高:CF4< CCl4< CBr4< CI4B.硬度由大到小:
下面的排序不正确的是A.晶体熔点由低到高:CF4< CCl4< CBr4< CI4B.硬度由大到小:金刚石 > 碳化硅 > 晶体硅C.熔点由高到低:Na > Mg > AlD
化合物Fe0.95O具有NaCl型结构。由于n(Fe)∶n(O)
化合物Fe0 95O具有NaCl型结构。由于n(Fe)∶n(O)<1,所以晶体存在缺陷,Fe0 95O可表示为A.B.C.D.
硒是一种非金属 可以用作光敏材料 电解锰行业催化剂。(l)Se是元素周期表中第34号元素 其基态原子
硒是一种非金属,可以用作光敏材料、电解锰行业催化剂。(l)Se是元素周期表中第34号元素,其基态原子的核外电子排布式为。(2)根据价层电子对互斥理论