确定物质性质的重要因素是物质结构.请回答下列问题.(1)已知A和B为第三周期元素 其原子的第一至第四
| 确定物质性质的重要因素是物质结构.请回答下列问题. (1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
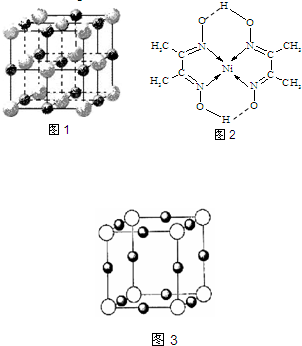
A的第一电离能______B的第一电离能(填“>”、“<”或“=”). (2)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图1所示,其中TiN中N呈-3价),已知3种离子晶体的晶格能数据如下表:
(3)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好.离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是______. (4)某配合物的分子结构如图2所示,其分子内不含有______(填序号). A.离子键 B.极性键 C.金属键 D.配位键 E.氢 键 F.非极性键 (5)某离子X+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体结构如右图所示.X的元素符号是______,与同一个N3-相连的X+有______个. (6)在硼酸[B(OH)3]分子中,B原子与3个羟基相连,其晶体具有与石墨相似的层状结构.则分子中B原子杂化轨道的类型及同层分子间的主要作用力分别是______ A.SP,范德华力 B.sp2,范德华力 C.sp2,氢键 D.sp3,氢键 (7)CaC2中
 |
参考解答
| (1)从表中原子的第一至第四电离能可以看出,A的第三电离能小,第四电离能较大,说明易失去3个电子, 则A的化合价为+3价,应为Al元素,B的第二电离较小,第三电离能较大,说明易失去2个电子,则B的化合价为+2价,应为Mg元素,镁的电负性小于铝的,而铝的第一电离能小于镁的; 故答案为:+3;>;<; (2)离子晶体的晶格能越大其熔点越高,晶格能与离子电荷成正比,与离子半径成反比,氮离子电荷大于镁离子和钙离子,镁、钙离子电荷大于钾离子,镁离子半径小于钙离子半径,所以4种离子晶体熔点从高到低的顺序是TiN>MgO>CaO>KCl,采用X、Y、Z三轴切割的方法知,镁离子周围和它最邻近且等距离的Mg2+有12个, 故答案为:TiN>MgO>CaO>KCl;12; (3)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好,V 5+核外电子排布式为1S22S22P63S23P6,核外没有孤电子,Cr4+核外电子排布式为1S22S22P63S23P63d1,有1个孤电子,所以适合作录音带磁粉原料的是CrO2,故答案为:CrO2; (4)该配合物中,碳原子和碳原子之间存在非极性共价键,碳原子和氢原子之间存在极性共价键,镍原子和氮原子之间存在配位键,氧原子和另一分子的氢原子间存在氢键, 故选AC; (5)某离子X+中所有电子正好充满K、L、M三个电子层,该离子含有28个电子,则该原子含有29个电子为铜元素,采用X、Y、Z三轴切割的方法知X+个数是6; 故答案为:Cu;6; (6)在硼酸[B(OH)3分子中,每个B原子含有3个σ键,不含孤电子对,所以采取sp2杂化,N、O、F与与另一分子的H原子易形成氢键,氢键比范德华力大,所以同层分子间的主要作用力是氢键,故选C; (7)CaC2中
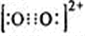 ,每个
故答案为: 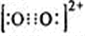 ;2NA. |
相似问题
下列过程与配合物的形成无关的是[ ]A.除去Fe粉中的SiO2可用强碱溶液 B.向一定量的A
下列过程与配合物的形成无关的是[ ]A 除去Fe粉中的SiO2可用强碱溶液 B 向一定量的AgNO3溶液中加入氨水至沉淀消失C 向FeCl3溶液中加入KSCN溶液D 向一定
下列分子或离子中键角由大到小排列顺序是[ ]①BF3 ②NH3 ③H2O ④NH4+ ⑤Be
下列分子或离子中键角由大到小排列顺序是[ ]①BF3 ②NH3 ③H2O ④NH4+ ⑤BeCl2 A.⑤④①②③ B.⑤①④②③ C.④①②⑤③ D.③②④①⑤
有A B C D E五种元素 其中A B C D为短周期元素 A元素的周期数 主族数 原子序数相同;
有A、B、C、D、E五种元素,其中A、B、C、D为短周期元素,A元素的周期数、主族数、原子序数相同;B原子核外有3种能量不同的原子轨道且每种轨道中的电子数
元素之间通过不同的化学键可以组成不同的晶体和化合物。有关化学键与晶体的说法正确的是A.两种元素组成的
元素之间通过不同的化学键可以组成不同的晶体和化合物。有关化学键与晶体的说法正确的是A.两种元素组成的分子中一定只有极性键B.熔融状态时能导电的化
Ⅰ.自从英国化学家巴特列(N.Bartlett)首次合成了第一个稀有气体的化合物XePtF6以来 人
Ⅰ 自从英国化学家巴特列(N Bartlett)首次合成了第一个稀有气体的化合物XePtF6以来,人们又相继发现了氙的一系列化合物,如XeF2、XeF4等。巴特列为开拓












