Ⅰ.自从英国化学家巴特列(N.Bartlett)首次合成了第一个稀有气体的化合物XePtF6以来 人
| Ⅰ.自从英国化学家巴特列(N.Bartlett)首次合成了第一个稀有气体的化合物XePtF6以来,人们又相继发现了氙的一系列化合物,如XeF2、XeF4等。巴特列为开拓稀有气体化学作出了历史性贡献。 (1)请根据XeF4的结构示意图(图1)判断这个分子是极性分子还是非极性分子?____________________。 (2)XeF2晶体是一种无色晶体,图2为它的晶胞结构图。XeF2晶体属于哪种类型的晶体?__________________。 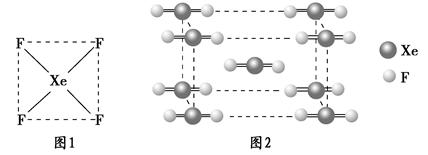 Ⅱ.已知有关物质的熔、沸点数据如下表:
请参考上述数据填空和回答问题: (1)工业上常用电解熔融MgCl2的方法生产金属镁,用电解Al2O3与冰晶石熔融混合物的方法生产铝。为什么不用电解MgO的方法生产镁,也不用电解AlCl3的方法生产铝? ___________________________________________________________________________________________________________________________________。 (2)设计可靠的实验证明MgCl2、AlCl3所属的晶体类型,其实验方法是___________________________________________________________________________________________________________________________________。 |
参考解答
| Ⅰ.(1)非极性分子 (2)分子晶体 Ⅱ.(1)因为MgO的熔点远高于MgCl2,故电解熔融MgO将需要更高的温度,消耗更多的能量,因而不用电解MgO的方法生产镁。观察表中数据可见,AlCl3易升华,熔、沸点低,故属于分子晶体,不存在离子,熔融时不能导电,不能被电解,因而不能用电解AlCl3的方法生产铝 (2)将两种晶体加热到熔融状态,MgCl2能导电,AlCl3不能导电。证明MgCl2为离子晶体,AlCl3为分子晶体 |
| Ⅰ.(1)由图1可看出该结构为高度对称,故为非极性分子。 (2)因Xe、F都为非金属元素,且结合图2结构图得为分子晶体。 Ⅱ.(1)因为MgO的熔点远高于MgCl2,故电解熔融MgO将需要更高的温度,消耗更多的能量,因而不用电解MgO的方法生产镁。观察表中数据可见,AlCl3易升华,熔、沸点低,故属于分子晶体,不存在离子,熔融时不能导电,不能被电解,因而不能用电解AlCl3的方法生产铝 (2)区别离子晶体和分子晶体就看两晶体在熔融状态下能否导电,若能导电,则为离子晶体;若不导电,则为分子晶体。 |
相似问题
最近发现 只含镁 镍和碳三种元素的晶体竟然也具有超导性 因这三种元素都是常见元素 从而引起广泛关注。
最近发现,只含镁、镍和碳三种元素的晶体竟然也具有超导性,因这三种元素都是常见元素,从而引起广泛关注。该新型超导晶体的一个晶胞如图所示,则该晶体
(12分)氮化硼(BN)晶体有多种结构。六方相氮化硼是通常存在的稳定相 与石墨相似 具有层状结构 可
(12分)氮化硼(BN)晶体有多种结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂。立方相氮化硼是超硬材料,有优异的耐
一项科学研究成果表明 铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO
一项科学研究成果表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)。 (1)向一定物质的量浓度的Cu(NO3)2和Mn(NO3)2溶液中加入N
卤素化学丰富多彩 能形成卤化物 卤素互化物 多卤化物等多种类型的化合物。(1)基态溴原子的简化电子排
卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。(1)基态溴原子的简化电子排布式为____。(2)卤素互化物如:IBr、ICl等与卤素
I.图表法 图象法是常用的科学研究方法。(1)短周期某主族元素M的电离能情况如甲图所示 则M元素位于
I.图表法、图象法是常用的科学研究方法。(1)短周期某主族元素M的电离能情况如甲图所示,则M元素位于周期表的第 ____族。(2)乙图是研究部分元素的氢化物












