金属晶体是面心立方体 立方体的每个面5个金原子紧密堆砌(如图其余各面省略) 金原子半径为d m 求(
金属晶体是面心立方体,立方体的每个面5个金原子紧密堆砌(如图其余各面省略),金原子半径为d m,求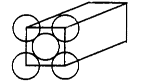 (1)金晶体中最小的一个立方体含有__________个金属原子。 (2) 欲计算一个晶胞的体积,除假定金原子是刚性小球外,还应假定 ; (3)计算一个晶胞的体积是 cm3; (4)金的密度为_________g?cm-3。 (5)列式计算金原子的空间利用率 |
参考解答
(1)4 (2) 立体各面上对角线上的球相切 (3)16 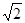 d3×106 d3×106(4)197/4 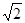 N d3×106 (5) N d3×106 (5)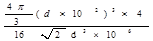 |
| (1)根据面心立方体的晶胞结构可知,含有的原子有8×1/8+6×1/2=4。 (2)还应假定立方体各面上对角线上的球是相切的。 (3)设立方体的边长是x。因为面对角线的是4d m,所以边长x=2 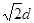 m。因此一个晶胞的体积是x3=16 m。因此一个晶胞的体积是x3=16 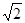 d3×106 cm3。 d3×106 cm3。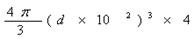 (4)1个晶胞的质量是 (4)1个晶胞的质量是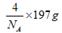 ,所以密度是 ,所以密度是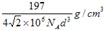 。 。(5)4个金原子的体积是 ,所以金原子的空间利用率为 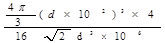 |
相似问题
硒有两种同素异形体:灰硒和红硒。灰硒溶于氯仿(CHCl3) 红硒溶于二硫化碳 它们都不溶于水 则灰硒
硒有两种同素异形体:灰硒和红硒。灰硒溶于氯仿(CHCl3),红硒溶于二硫化碳,它们都不溶于水,则灰硒和红硒的晶体属于A.原子晶体B.分子晶体C.金属晶
下面有关晶体的叙述中 错误的是A.金刚石的网状结构中 由共价键形成的最小碳环上有6个碳原子B.在Na
下面有关晶体的叙述中,错误的是A.金刚石的网状结构中,由共价键形成的最小碳环上有6个碳原子B.在NaCl晶体中每个Na+(或Cl-)周围都紧邻6个Cl-(或6个N
关于SiO2晶体的叙述中 正确的是( )A.通常状况下 60 g SiO2晶体中含有的分子数为NA
关于SiO2晶体的叙述中,正确的是( )A.通常状况下,60 g SiO2晶体中含有的分子数为NA(NA表示阿伏加德罗常数)B.60 g SiO2晶体中,含有2NA个Si—
(11分)某合金由A B C D 四种元素组成 这四种元素位于周期表中前四周期 A是主要成分元素 A
(11分)某合金由A、B、C、D 四种元素组成,这四种元素位于周期表中前四周期,A是主要成分元素,A的基态原子中有4个未成对电子。B是第一主要的合金元素
下列叙述不正确的是( )A 金刚石晶胞()中平均含有的碳原子数 碘晶体晶胞中平均含有的原子数均为8B
下列叙述不正确的是()A金刚石晶胞()中平均含有的碳原子数、碘晶体晶胞中平均含有的原子数均为8B二氧化硅晶体中最小环上的氧原子数、氯化铯晶体中氯离












