有A B C D四种短周期元素 它们的原子序数由A到D依次增大 已知A和B原子有相同的电子层数 且A
| 有A、B、C、D四种短周期元素,它们的原子序数由A到D依次增大,已知A和B原子有相同的电子层数,且A的最外层电子数是次外层电子数的两倍;C燃烧时呈现黄色火焰,C的单质在加热条件下与B的单质反应,可以得到与D单质颜色相同的固态化合物;D的最高价与最低价代数和为其最低价绝对值的两倍.根据以上叙述回答: (1)写出A与B两元素所形成的最高价化合物的电子式:______;该化合物分子所含的化学键属于(极性键或非极性键)______;该化合物分子属于(极性分子或非极性分子)______. (2)A元素与氢元素按原子个数比1:4形成的化合物的结构式为______,其空间构型是______. (3)用电子式表示C与D两元素组成的化合物的形成过程:______. |
参考解答
| 已知A和B原子有相同的电子层数,应为相同周期,A的最外层电子数是次外层电子数的两倍,应为C元素;C燃烧时呈现黄色火焰,应为Na元素,其单质在加热条件下与B的单质反应,可以得到与D单质颜色相同的固态化合物,则B为O,与Na反应的化合物为Na2O2,为淡黄色固体,D应为S元素,最高价与最低价代数和为其最低价绝对值的两倍, 则A为C,B为O,C为Na,D为S, (1)A为C,B为O,两元素所形成的最高价化合物为CO2,为共价化合物,电子式为 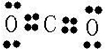 ,分子中含有C=O键,为极性键,分子结构为O=C=O,结构对称吗,正负电荷重心重叠,为非极性分子, 故答案为: 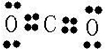 ;极性键;非极性分子; (2)C与H按原子个数比1:4形成的化合物为CH4,空间结构为 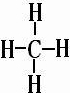 ,为正四面体结构,故答案为:  ;正四面体结构; (3)C为Na,D为S,形成的化合物为Na2S,用电子式可表示的形成过程为 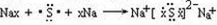 , 故答案为: 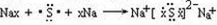 . |
相似问题
在短周期元素中 原子最外电子层只有1个或2个电子的元素( )A.是非金属元素B.是稀有气体元素C.
在短周期元素中,原子最外电子层只有1个或2个电子的元素( )A.是非金属元素B.是稀有气体元素C.是金属元素D.无法确认为哪一类元素
X元素的阳离子与Y元素的阴离子具有相同的电子层结构 下列叙述正确的是( )A.原子序数X<YB.原
X元素的阳离子与Y元素的阴离子具有相同的电子层结构,下列叙述正确的是( )A.原子序数X<YB.原子半径X<YC.离子半径X>YD.原子最外层电子数X<Y
A B C D E 5种元素 A元素所处的周期数 主族序数 原子序数均相等;B是地壳中含量最多的元素
A、B、C、D、E5种元素,A元素所处的周期数、主族序数、原子序数均相等;B是地壳中含量最多的元素;C元素原子的最外层电子数比次外层少2个;C的阴离子与D
A B C D E五种元素 它们的质子数依次递增 但都小于18.A元素原子核外只有1个电子.B元素原
A、B、C、D、E五种元素,它们的质子数依次递增,但都小于18.A元素原子核外只有1个电子.B元素原子和C元素原子最外层电子数之差为2.B元素原子最外层上的
六种短周期主族元素A B C D E F的原子序数依次增大 其中A与E周主族 B与F同主族.已知常温
六种短周期主族元素A、B、C、D、E、F的原子序数依次增大,其中A与E周主族,B与F同主族.已知常温下单质A与E的状态不同,D的核电荷数是B的最外层电子数的2












