(1)过渡金属元素铁能形成多种配合物 如:[Fe(H2NCONH2)6] (NO3)3[三硝酸六尿素
| (1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6] (NO3)3[三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等。 ① 基态Fe3+的M层电子排布式为 。 ② 尿素(H2NCONH2)分子中C、N原子的杂化方式分别是 、 ; ③ 配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x= 。 Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于 (填晶体类型) 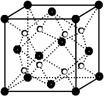 (2)O和Na形成的一种只含有离子键的离子化合物的晶胞结构如右图,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为 。已知该晶胞的密度为ρ g/cm3,阿伏加德罗常数为NA,求晶胞边长a= cm。 (用含ρ、NA的计算式表示) (3)下列说法正确的是 _。 A.第一电离能大小:S>P>Si B.电负性顺序:C<N<O<F C.因为晶格能CaO比KCl高,所以KCl比CaO熔点低 D.SO2与CO2的化学性质类似,分子结构也都呈直线型,相同条件下SO2的溶解度更大 E.分子晶体中,共价键键能越大,该分子晶体的熔沸点越高 (4)图1是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体。  ① 图中d单质的晶体堆积方式类型是 。 ② 单质a、b、f 对应的元素以原子个数比1:1:1形成的分子中含 个σ键, 个π键。 ③ 图2是上述六种元素中的一种元素形成的含氧酸的结构,请简要说明该物质易溶于水的原因: 。 |
参考解答
| (1)①3s23p63d5 (1分) ② sp2(1分) sp3(1分) ③ 5(1分)分子晶体(1分) (2)立方体(1分) 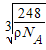 (2分) (2分) (3)BC(2分)(漏选得1分,多选、错选不得分) (4)①面心立方最密堆积 (1分)② 2 (1分) 2(1分) ③硝酸分子是极性分子,易溶于极性溶剂的水中 硝酸分子中氢氧键易与水分子间形成氢键(2分) |
试题分析:(1)①Fe原子核外有26个电子,核外电子排布为1s22s22p63s23p63d64s2,Fe原子失去4s能级2个电子、3d能级1个电子形成Fe3+,Fe3+电子排布式为1s22s22p63s23p63d5,基态Fe3+的M层电子排布式为3s23p63d5 。 ②由尿素分子的结构式 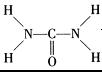 可知,尿素分子中C原子成2个C-N键、1个C=O键,没有孤对电子,杂化轨道数目为3,C原子采取sp2杂化,N原子成3个单键,含有1对孤对电子,杂化轨道数为4,N原子采取sp3杂化,故答案为:sp2、sp3; 可知,尿素分子中C原子成2个C-N键、1个C=O键,没有孤对电子,杂化轨道数目为3,C原子采取sp2杂化,N原子成3个单键,含有1对孤对电子,杂化轨道数为4,N原子采取sp3杂化,故答案为:sp2、sp3;③ 配合物Fe(CO)x的中心原子是铁原子,其价电子数是8,每个配体提供的电子数是2,8+2x=18,x=5,分子晶体的熔沸点较低,根据题给信息知,该物质的熔沸点较低,易溶于非极性溶剂,所以为分子晶体; (2)距一个阴离子周围最近的所有阳离子为顶点构成的几何体是立方体,该晶胞中钠离子个数是8,氧离子个数=8× 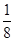 +6× +6×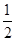 =4,V= =4,V=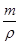 = =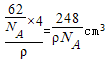 ,则 ,则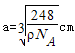 ; ; (3)A.同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第VA族元素的第一电离能大于相邻元素,所以第一电离能大小:P>S>Si,故A错误; B.同一周期元素中,元素的电负性随着原子序数的增大而增大,所以电负性顺序:C<N<O<F,故B正确; C.晶格能与离子晶体的熔点成正比,离子半径与晶格能成反比,离子所带电荷与晶格能成正比,钙离子电荷大于钾离子,且钙离子半径小于钾离子,氯离子所带电荷小于氧离子,且氯离子半径大于氧离子,所以氯化钾的晶格能小于氧化钙,则氯化钾的熔点比氧化钙低,故C正确; D.二氧化硫分子中硫原子的价层电子对是3且含有一个电子对,所以二氧化硫是V形结构,为极性分子,二氧化碳是非极性分子,根据相似相溶原理知,二氧化硫易溶于水,故D错误; E.分子晶体中,物质的熔沸点与其相对分子质量成正比,故D错误; 故选BC; (4)①d单质是热和电的良导体,且熔点较高,则为铜,铜为面心立方最密堆积; ②根据熔点知,a是H元素,b是N元素,f是C元素,a、b、f 对应的元素以原子个数比1:1:1形成的分子为HCN,其结构为H-C≡N,共价单键为σ键,共价双键中一个是σ键一个是π键,三键中一个是σ键两个是π键,所以该分子中含有2个σ键2个π键; ③根据图知,该分子中含有一个氢原子、三个氧原子和一个氮原子,为硝酸分子,硝酸分子正负电荷重心不重合,为极性分子,且硝酸和水能形成氢键而增大硝酸的溶解性。 |
相似问题
Ⅰ.下列有关说法正确的是________。A.相同类型的离子晶体 晶格能越大 形成的晶体越稳定B.手
Ⅰ 下列有关说法正确的是________。A.相同类型的离子晶体,晶格能越大,形成的晶体越稳定B.手性催化剂只催化或者主要催化一种手性分子的合成C.用金属
元素X原子的最外层有6个电子 元素Y原子的最外层有3个电子 这两种元素形成的化合物的化学式可能是[
元素X原子的最外层有6个电子,元素Y原子的最外层有3个电子,这两种元素形成的化合物的化学式可能是[ ]A.XY2 B.X2Y C.Y3X2D.Y2X3
A B C D是元素周期表中前36号元素 它们的核电荷数依次增大。第二周期元素A原子的核外成对电子数
A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大。第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道
金属钛性能优越 被誉为继Fe Al后应用广泛的“第三金属”。(1)写出Ti基态原子的电子排布
金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”。(1)写出Ti基态原子的电子排布。(2)钛能与B、C、N、O等非金属元素形成稳定的化合物。则电负性C
(13分)【化学—物质结构与性质】氮 磷属于同主族元素 广泛存在于生产生活的各种物质中。(1)N原子
(13分)【化学—物质结构与性质】氮、磷属于同主族元素,广泛存在于生产生活的各种物质中。(1)N原子价电子轨道表示式;(2)PCl5晶体中只有PCl4+和PCl












